|
|
|
|||||||||||||||||||||||||||||
|
|
|
Sources : |
||||||||||||||||||||||||||||
|
Plan : |
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||
|
|
La structure du nucléoïde bactérien observé en ME - sous forme d'une zone plus claire, moins opaque aux électrons et souvent attachée à la membrane cellulaire (voir cours de seconde) - reste mal connue. Pour une image au MET voir par exemple le site de Markus Drechsler (E. coli au MET en coloration négative à l'uranylacétate). |
|
Il contiendrait environ 60% d'ADN, un peu d'ARN et près de 40% de protéines (mais ce n'est pas le cas de toutes les bactéries, certaines contiennent un nucléoïde d'ADN presque pur). La forme "théorique" ou plutôt le modèle, qui cadre avec les résultats expérimentaux, serait une boucle unique entortillée et empaquetée grâce à des protéines de type non-histones (différentes des protéines de la chromatine et du chromosome eucaryote) (voir chromosome). La taille de l'unique molécule d'ADN en boucle serait d'environ 1400µm chez Escherichia coli. |
|
De petits ADN circulaires ou plasmides sont le plus souvent présents dans le cytoplasme. Ils ne sont pas indispensables à la division cellulaire mais contiennent des gènes pouvant être exprimés. |
|||||||||||||||||||||||||
|
|
|
Pour simplifier, par commodité, et comme c'est l'usage, nous représenterons l'ADN bactérien comme une unique boucle d'ADN de petite taille non enroulée. |
||||||||||||||||||||||||||||
|
Cours de seconde: |
|
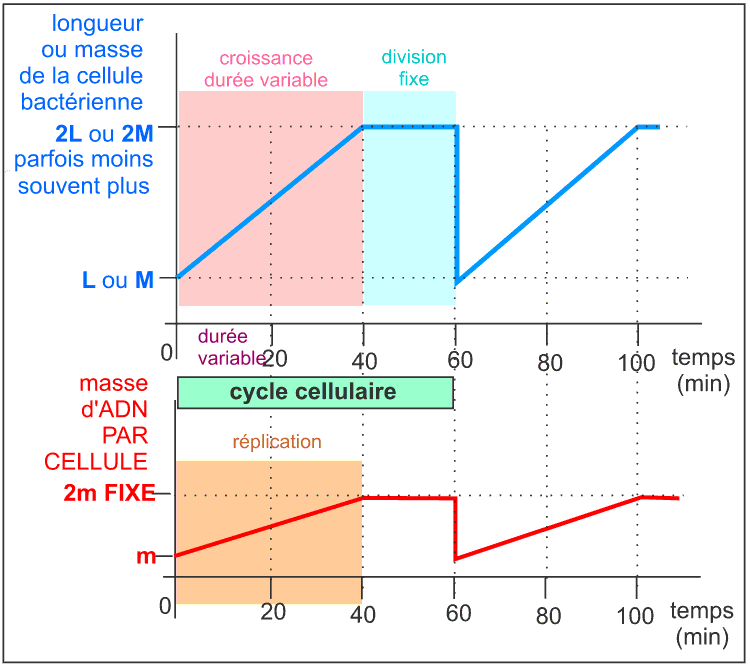
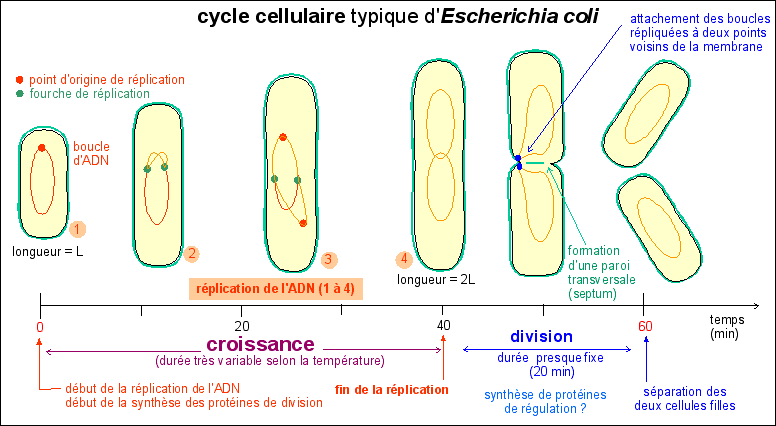
Le cycle cellulaire comprend les événements situés entre deux divisions. Il commence donc, pour une cellule, lors de sa séparation d'avec sa cellule sœur; et finit lors de sa séparation en deux cellules filles. |
|
Le cycle cellulaire commence par un allongement de la cellule, sans augmentation de diamètre, qui atteint ainsi 2 fois sa longueur initiale : c'est la croissance cellulaire. Comme il n'y a pas d'augmentation de diamètre on peut penser que la masse initiale double pendant cette croissance étant donné que la bactérie peut être assimilée à un cylindre de diamètre constant. Pendant cette croissance l'ADN est dupliqué et de nombreuses protéines dites protéines de division sont synthétisées. |
|
Si l'on bloque la réplication de l'ADN on empêche la division et la cellule s'allonge démesurément en formant un long filament. La division cellulaire commence presque toujours, quelque soient les conditions de culture de la bactérie et donc quelque soit la durée du cycle cellulaire, 20 minutes avant la fin de la réplication. |
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
Le cycle cellulaire - d'une durée de 60 min - d'une souche d'Escherichia coli à croissance lente |
|
 |
||||||||||||||||||||||||||
|
|
|
Si la division est fort mal connue, la réplication de l'ADN est de loin le mécanisme le mieux connu de tout le cycle cellulaire des Procaryotes. Elle a particulièrement été étudiée chez Escherichia coli. |
|
L'expérience historique de Meselson et Stahl a permis de préciser le type de mécanisme de réplication de l'ADN. |
|
|
||||||||||||||||||||||||
|
|
|
Expérience de Meselson et Stahl (1958) Bordas p 101; Nathan p 112 |
||||||||||||||||||||||||||||
|
|
|
Escherichia coli est cultivée pendant de nombreuses générations (= durée d'un cycle cellulaire puisqu'une génération sépare une cellule mère de sa cellule fille) sur un milieu de culture contenant des désoxyribonucléotides marqués à l'15N (témoin 1). Cette souche de départ est transférée pendant un génération sur un milieu contenant uniquement des désoxyribonucléotides marqués à l'14N (expérience 1). Enfin on transfère des bactéries issues de cette culture à nouveau sur un milieu contenant uniquement des désoxyribonucléotides marqués à l'15N (expérience 2). |
|
La mesure de la quantité de désoxyribonucléotides incorporés dans l'ADN lors de la phase de réplication (croissance cellulaire) se fait à l'aide de prélèvement de bactéries dont l'ADN est extrait et centrifugé sur gradient de densité; l'ADN se plaçant plus ou moins bas dans le tube selon sa densité. La bande d'ADN, fluorescente sous U.V. est révélée par éclairement U.V. du tube. Une densité de 1,8 signifiant un ADN ne contenant quasiment que de l'15N et une densité de 1,65 signifiant un ADN ne contenant quasiment que de l'14N. |
|
Le tube 2 correspond à un témoin d'une souche cultivée pendant de nombreuses génération sur sur milieu contenant des désoxyribonucléotides marqués à l'14N. Le tube 5 correspond à une génération supplémentaire sur milieu contenant des désoxyribonucléotides marqués à l'14N (expérience 3). |
||||||||||||||||||||||||
|
|
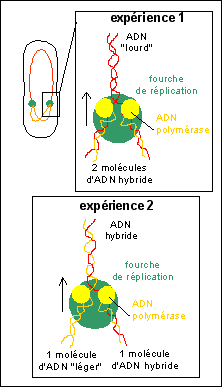 Une illustration de l'interprétation du mécanisme de réplication semi-conservative de l'ADN dans l'expérience de Meselson et Stahl. |
||||||||||||||||||||||||||||
|
interprétation: Les témoins correspondent à des bactéries dont la quasi-totalité de l'ADN est composé de désoxyribonucléotides possédant de l'14N (témoin 2) qualifié d'ADN "léger" ou de l'15N (témoin 1) qualifié d'ADN "lourd". |
|
Dans l'expérience 1 (tube 3) la position de l'ADN intermédiaire en densité entre l'ADN léger et de l'ADN lourd permet de dire que le mécanisme de réplication de l'ADN, qui s'est normalement déroulé une seule fois depuis le transfert sur milieu léger, est semi-conservatif. En effet, les molécules d'ADN obtenues lors de la réplication contiennent TOUTES pour moitié de l'14N et de l'15N. Ce qui peut s'expliquer aisément si l'on imagine un système de réplication qui conserve un des brins anciens dans chaque nouvelle molécule et synthétise un brin nouveau complémentaire. Les deux molécules d'ADN issues d'une telle réplication sont donc identiques et pour un brin (nouveau) composées d'14N et pour l'autre brin (ancien) composées d'15N. On peut parler de molécules hybrides 14N-15N. |
|
Lors d'une seconde réplication
avec des désoxyribonucléotides contenant de
l'14N (milieu "léger"), les
molécules hybrides sont aussi
répliquées selon un mécanisme
semi-conservatif qui donnera une molécule d'ADN
léger et une molécule d'ADN hybride à
partir de chaque molécule ancienne (hybride).
|
|
|||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||
|
Généralisation |
|
La
réplication de l'ADN est une
synthèse de deux
molécules d'ADN identiques à partir d'une
molécule d'ADN. Chaque molécule d'ADN
fille est composée d'un brin ancien et d'un brin
nouveau complémentaire du brin ancien; on dit que la
réplication est semi-conservative. La
réplication de l'ADN est catalysée par un gros
complexe enzymatique contenant plus de 20 enzymes mais
surtout l'ADN polymérase. La réplication
commence en un point origine et se poursuit en
général dans deux sens opposés au
niveau de fourches de réplication.
|
|
|
||||||||||||||||||||||||||
|
|
|
L'ADN polymérase nécessite une molécule d'ADN à répliquer, des désoxyribonucléotides, de l'énergie (ATP) et un petit fragment d'ARN complémentaire d'une petite séquence de l'ADN à répliquer (amorce). Il existe plusieurs ADN polymérases chez les bactéries (au moins 3) et plus encore chez les eucaryotes. |
|
La réplication se déroule avec une fidélité excellente: chez E. coli on estime le nombre d'erreurs de copie à 1 pour 109 à 1010 nucléotides, ce qui fait, pour un génome évalué à 4,7.106 paires de bases, une erreur pour 1.000 à 10.000 réplications. Il existe des systèmes de réparation de l'ADN qui utilisent aussi une ADN polymérase. La vitesse de polymérisation (ajout des désoxyribonucléotides pour former le nouveau brin) est de l'ordre de 20 à 1.000 nucléotides par seconde chez E. coli.
|
|
Le problème du déterminisme du cycle cellulaire est aussi celui du lien entre la croissance cellulaire et la réplication de l'ADN.... il est loin d'être résolu. En tout il ne sera pas traité dans ces pages. |
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||
|
|
Nous avons vu en seconde que E. coli vit en colonies habituellement, ou, mieux, que cet organisme pouvait être considéré comme pluricellulaire, et que le rythme de multiplication de chaque cellule dépend de son âge dans l'organisme (la colonie) et des conditions nutritionnelles. Une cellule d'E. coli contient en moyenne 6 molécules d'ADN plus ou moins en réplication. |
|
Que signifie donc la mise en culture sur milieu lourd ou léger pendant une génération ? Le raisonnement interprétatif de l'expérience suppose qu'un nombre n de bactéries s'est multiplié en 2n pendant la durée de l'expérience et que la quantité d'ADN q a été multipliée de la même manière en 2q. |
|
On est ainsi amené naturellement à se pencher sur l'article original. On découvre alors un continent peu exploré qui relève de l'histoire des sciences... qui nécessite bien sûr un peu de maîtrise de l'anglais scientifique depuis la seconde moitié du XXème siècle. |
|||||||||||||||||||||||||
|
|
Les nos portés ci-dessous entre parenthèses seront utilisés pour des renvois aux articles |
En travaux |
||||||||||||||||||||||||||||
|
(1)
article original
: (4) Parmi les références citées (10) sur la méthode d'équilibre sur gradient de concentration voir une autre publication de l'équipe : Equilibrium sedimentation of macromolecules in density gradients, M. S. Meselson, F. W. Stahl, and J. Vinograd, 1957, PNAS, 43, 581 |
|
Deux articles récents: |
||||||||||||||||||||||||||||
|
Sur les conditions de l'expérience des questions apparaissent: |
|
Quelles sont les voies de synthèse de l'ADN envisagées ici et comment l'azote est-il concrètement utilisé ? |
|
Biosynthèse et dégradation des nucléotides in Principes de biochimie, Lehninger, Nelson et Cox, 1994, Médecine-Sciences, Flammarion, p 715 et s) |
||||||||||||||||||||||||||
|
De nombreux composés cellulaires sont probablement marqués à l'14N ou à l' 15N. La technique employée ne permet pas de les explorer. |
|
Le milieu de culture contient : On notera aussi que le milieu n'était pas fourni en une seule fois mais que la concentration en bactéries était maintenue plus ou moins fixe par addition de milieu marqué. |
|
|
|
Chez les bactéries la synthèse d'ADN se fait à partir de désoxyribonucléotides triphosphates, d'une amorce ARN et de complexes enzymatiques de type ADN polymérases (3 sont connues chez E. coli depuis les années 1970). D'autres complexes protéiques nécessaires sont aujourd'hui connus (primosome, hélicases, topo-isomérases...). La synthèse des nucléotides
n'est bien sûr pas réalisée selon une
voie unique; on distingue habituellement les voies de
novo, à partir de précurseurs (aa,
ribose*, CO2 et NH3) et les voies de
récupération à partir des bases et
acides nucléiques libérés par
destruction des acides nucléiques. Les
nucléotides ne sont pas synthétisés
à partir des bases libres mais les noyaux
azotés sont synthétisés à partir
du ribose-5-phosphate. Les désoxyribonucléotides* sont ensuite synthétisés à partir des ribonucléotides* (par la ribonucléotide réductase). Les nucléotides à thymine proviennent des désoxyribonucléotides dCDP et dUMP . Ces deux éléments expliquent qu'il ne soit pas utile d'ajouter ni des désoxyribosides ni une thymidine. |
||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
En travaux |
||||||||||||||||||||||||||
|
La technique ne permet pas de savoir la cause exacte de la différence de densité. |
|
La séparation de molécules en fonction de leur densité par sédimentation dans un gradient de densité de ClCs a été longuement étudiée par Mat Meselson qui en a fait son sujet de thèse (deuxième partie) sous la direction de Linus Pauling (2). L'application faite à la possible séparation des molécules d'ADN nouvellement formées par réplication a été une suite logique. |
|
Pour appréhender les principes de l'analyse des pics d'absorption observés je conseille la lecture d'un article de 1957 (4): Equilibrium sedimentation of macromolecules in density gradients, M. S. Meselson, F. W. Stahl, and J. Vinograd, 1957, PNAS, 43, 581 |
|
La technique ne présente des pics gaussiens - qui furent obtenus en (1) après de multiples essais INFRUCTUEUX rapportés mais non documentés (voir ci-contre) - que si on imagine obtenir un seul type de substances de MÊME DENSITÉ et HOMOGÈNES. Pour l'ADN considéré, les molécules peuvent être de plus ou moins grande taille, contenir plus ou moins d'atomes lourds, être plus ou moins hydratées (ne pas oublier que l'ADN contient une grande quantité d'eau : 80% du poids de la molécule d'ADN (voir page sur la cellule)... Il faudrait donc considérer que dans l'expérience (1) les molécules d'ADN ont été effectivement fragmentées de façon homogène par le pipettage (voir ci-contre) et qu'ensuite le traitement utilisé pour lyser les bactéries (voir plus haut (1) réfrigération, centrifugation, NaCl, EDTA, dodecylsulfate de sodium...) n'a pas modifié la teneur en eau de l'ADN (ou l'a modifié de façon homogène)... Si l'on considère que la densité n'est pas due à l'ADN mais à l'eau de solvatation qui emprisonne une quantité relativement homogène de (14N ou 15N)H4Cl qui résiste au lavage on peut interpréter aisément les résultats obtenus DE FAÇON TOUT À FAIT HYPOTHÉTIQUE. Une densité intermédiaire après un bref passage sur un milieu de 14NH4Cl. Après un passage plus long, on sépare une certaine quantité d'ADN qui n'est plus solvaté que par de l'eau enrichie au 14NH4Cl. La méthode n'étant pas quantitative il est fort difficile de comprendre quel mécanisme est plus ou moins révélé ici. Si l'on tient compte ensuite du nombre moyen de molécules d'ADN dans chaque cellule (environ 6) le "temps de génération" utilisé serait donc plutôt le temps nécessaire au renouvellement de l'eau de solvatation de l'ADN ....
|
||||||||||||||||||||||||
|
|
|
(voir extrait de la réf 2 ci-contre ------->) |
|
The stress of the pipetting caused tremendous shearing of the DNA, although they did not realize this at the time, nor did they realize how critical this would be to obtaining clean peaks.» (2) |
|
|||||||||||||||||||||||||
|
|
|
Mais nos connaissances modernes sur l'eau dans l'ADN portent le questionnement bien au-delà. |
|
|
|
|||||||||||||||||||||||||
|
Des affirmations que je pense pouvoir avancer à partir des sources citées ci-dessus : |
|
|
|
|
||||||||||||||||||||||||||
|
|
Les expériences de Meselson et Stahl ont été conçues dans le but de conforter l'hypothèse de la double hélice de Watson et Crick.
|
|
Les mécanismes compliqués de déroulement et de coupure-collage de la chaîne d'ADN en amont du point de réplication (topoisomérases)(2) sont venus apporter de possibles confortations des hypothèses admises pour ces expériences mais la taille des fragments d'ADN envisagés reste un problème. |
|
D'autres interprétations mériteraient d'être explorées chimiquement dans l'optique d'un ADN cytoplasmique sous une phase plus condensée et moins dépendante de l'imaginaire dépassé d'une molécule unique d'acide désoxyribonucléique double brin (voir ci-dessous le raisonnement de Taylor qui est aussi simpliste pour les chromosomes de la vesce). |
|||||||||||||||||||||||||
|
|
|
en travaux |
|
|
||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||
|
|
Les différents états de l'ADN ont déjà été vus en seconde : chromatine pendant l'interphase et chromosome pendant la mitose. |
|
||||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
Le cycle cellulaire des eucaryotes à surtout été étudié chez la levure de bière. Les données obtenues chez les cellules en culture et les cellules embryonnaires sont les plus nombreuses pour les animaux. Selon l'organisme, l'âge de la cellule, et le type cellulaire, on a des différences fondamentales. Seuls quelques points communs seront présentés ici. |
||||||||||||||||||||||||||||
|
|
|
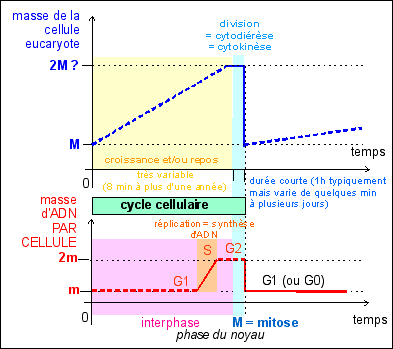
Le cycle cellulaire des cellules eucaryotes est beaucoup plus variable que celui des cellules procaryotes. Deux phases sont toujours observées:
|
||||||||||||||||||||||||||||
|
|
|
En interphase le noyau est au repos du point de vue de la division mais pas de la synthèse car c'est en phase S de l'interphase qu'a lieu la réplication de l'ADN qui précède toute division (sauf dans le cas de la deuxième division de la méiose, voir cours de terminale). |
|
L'expérience de Taylor met en évidence une caractéristique essentielle de cette phase de réplication: c'est une réplication semi-conservative. Elle fait appel aux mêmes mécanismes que la réplication chez les procaryotes. Du fait de la longueur du génome, elle commence en de multiples points origine simultanément. (Il faudrait plus de 500 h à raison de 50 nucléotides à la seconde pour répliquer un seul chromosome humain à partir d'un seul point origine). |
|
Les molécules d'ADN polymérases et les nombreuses enzymes associées sont bien moins connues que chez les procaryotes. |
||||||||||||||||||||||||
|
|
|
Expérience de Taylor (1957) Bordas p 100* *cette expérience scolaire n'est pas l'expérience historique de Taylor qui sera analysée plus bas |
||||||||||||||||||||||||||||
|
|
|
Les cellules eucaryotes cultivées in vitro sont des fragments racinaires de Bellevalia romana, une plante de la famille du Lys. La réplication de l'ADN est suivie à l'aide de thymidine tritiée (la thymidine est le nucléoside (thymine + sucre)) marquée par le tritium (3H ou 3T) isotope lourd et radioactif de l'hydrogène. |
|
L'incorporation du désoxyribonucléotide radioactif est suivi par des autoradiographies qui sont des expositions de préparations cellulaires à une plaque ou un film photographique. Les composés argentés de l'émulsion photographique précipitent lorsqu'ils rencontrent un électron émis par radioactivité ß- par les atomes de 3H incorporés dans le thymidine radioactive. Les grains d'argent forment des points noirs que le développement révèle. L'emplacement des points noirs indique donc de façon approximative la position des molécules de thymidine tritiée de la préparation cellulaire. Les temps d'exposition des émulsions photographiques sont bien sûr beaucoup plus longs que pour une impression par les photons. |
|
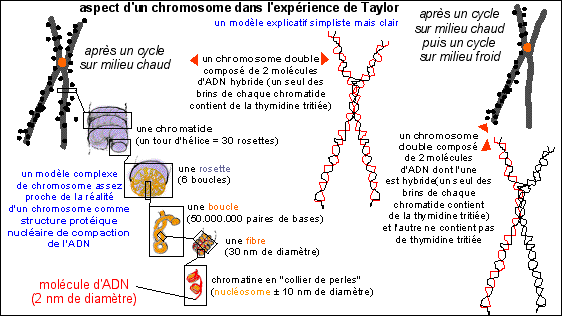
Les racines de Bellevalia romana, sont cultivées pendant la durée d'un cycle cellulaire sur un milieu "chaud", c'est-à-dire contenant de la thymidine tritiée. Les cellules en métaphase de mitose sont repérées et certaines sont autoradiographiées. L'aspect d'un chromosome est représenté ci-dessous à gauche. Certaines de ces cellules sont replacées immédiatement sur un milieu "froid", c'est-à-dire dépourvu de thymidine radioactive , pendant la durée d'un deuxième cycle cellulaire. L'aspect d'un chromosome d'une autoradiographie d'une cellule en prophase de mitose est présentée ci-dessous à droite. |
||||||||||||||||||||||||
|
Illustration de
l'interprétation de l'expérience de Taylor |
|
|
||||||||||||||||||||||||||||
|
Explication de l'expérience: |
|
Tout en n'oubliant pas que le chromosome est une structure complexe de compaction de l'ADN nucléaire (comme le représente le schéma ci-contre - l'ADN d'une cellule humaine est estimé à environ 2 m soit quelques centimètres par chromosome pour un diamètre de 2 nm soit un rapport longueur sur diamètre de quelques dizaines de millions !!!!) on s'intéresse à la composition de chaque chromatide.
|
|
Les chromatides radioactives sont composées d'une molécule d'ADN hybride. C'est-à-dire que la molécule d'ADN hybride à incorporé dans UN de ses brins, le brin nouvellement formé, de la thymidine tritiée. Cette incorporation n'a lieu que pendant la phase S du cycle cellulaire (synthèse de l'ADN) et ne touche donc que les cellules qui étaient dans cette phase de l'interphase peu après le début de la mise en culture. Lorsque les cellules sont retirées du milieu chaud et observées, seules celles qui se trouvent maintenant en métaphase peuvent présenter de tels chromosomes. |
|
Le fait que les deux chromatides, issues de la réplication de l'ADN en phase S de l'interphase, sont TOUTES LES DEUX hybrides (c'est-à-dire composées d'un brin ancien, non radioactif et d'un brin nouveau ayant incorporé de la thymidine tritiée radioactive) peut être expliqué par un mécanisme semi-conservatif de la réplication de l'ADN, comme chez les Procaryotes. |
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
Place de la réplication dans le cycle cellule d'une cellule eucaryote et aspect très schématique des chromosomes au cours des différentes phases nucléaires. |
|
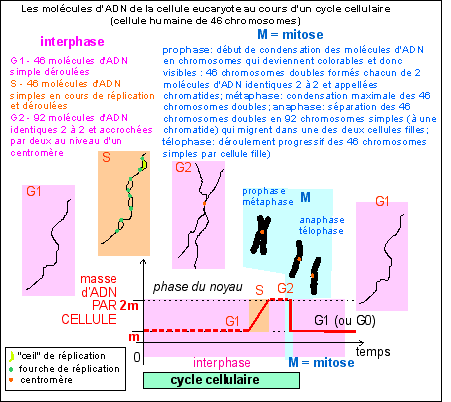 |
Le "piège" pour un élève inattentif vient de ce que certains auteurs qualifient, improprement, de chromosome, tout filament d'ADN de la cellule. Ce mot doit être réservé aux structures colorables et donc composées d'ADN et de PROTÉINES de la cellule en phase M du noyau (voir chromosomes ou l'ancien cours de spécialité de terminale). |
|||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||
|
Les étapes de la mitose sont classiquement regroupées en 4 phases qui présentent bien sûr des limites parfois floues ou chevauchantes: |
|
* la prophase
où la chromatine se condense et forme les
chromosomes qui deviennent COLORABLES et VISIBLES en
microscopie optique; ce sont des chromosomes doubles
(à deux chromatides issues de la réplication
en phase S de l'interphase); l'enveloppe nucléaire se
désagrège par fragmentation des citernes du
réticulum qui entourent le nucléoplasme ;
|
|
* la
métaphase où les chromosomes MIGRENT
car ils sont TIRÉS par les microtubules
kinétochoriens et se disposent de part et d'autre du
plan équatorial de la cellule en division; ce plan
décrit de façon précise l'orientation
des deux cellules filles
(il est
matérialisé par un anneau ou un disque de
filaments d'actine, voir page
suivante);
si la cellule est étirée, ce plan peut diviser
la cellule longitudinalement ou transversalement ce qui
donnera une division en épaisseur ou en longueur,
déterminante pour la croissance des cellules
végétales à paroi par exemple; entre
les deux pôles de division, situés
symétriquement par rapport au plan équatorial,
se mettent en place des microtubules qualifiés de
fusoriaux car ils dessinent un fuseau de division;
|
||||||||||||||||||||||||||
|
|
|
* l'anaphase où les chromosomes doubles SE SCINDENT au niveau des centromères, chaque chromosome fils (composé d'une chromatide) est TIRÉ vers l'un des pôles de la cellule par ses microtubules kinétochoriens qui glissent le long des microtubules du fuseau de division; |
|
* la télophase où les chromosomes se déroulent et les filaments d'ADN redeviennent NON COLORABLES sous forme de chromatine; l'enveloppe nucléaire se met à nouveau en place autour du nucléoplasme. |
||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||
|
Une fois encore l'effort qui
consisterait, pour une classe (TPE SVT-anglais ?), tout
comme pour un enseignant (curieux), à travailler sur
le texte original, serait d'une extrême richesse. |
|
l'article
original est accessible : |
||||||||||||||||||||||||||||
|
----> |
|
In the second group, cells contained either 12, 24, or 48 chromosomes. Those with 12 chromosomes usually were not labeled, but when labeling occurred, sister chromatids were uniformly labeled as in the first group. In cells with 24 chromosomes, all chromosomes were labeled; however, only one of the two sister chromatids of each was radioactive (Fig. 2, a and b). Evidently the pool of labeled precursor in the plant had been quickly depleted after the plant was removed from the isotope solution, and these cells with 24 chromosomes had gone through a second duplication in the absence of labeled thymidine. In the few cells with
48 chromosomes, analysis of all 48 was not possible.
However, in several cases where most of the chromosomes were
well separated and flattened, approximately one-half of the
chromosomes of a complement contained one labeled and one
nonlabeled chromatid, while the remainder showed no label in
either chromatid. The appearance of cells with 48
chromosomes in a 34-hour period in colchicine also indicates
that there was some variation in the predicted 24-hour
division cycle. |
|
Remarque: dans
le texte, l'auteur parle de duplication de la
cellule à la place des duplication de
l'ADN à l'interphase, ce qui est déjà
un vocabulaire qui suppose l'interprétation qui tend
ici à être prouvée. C'est plus que
déroutant.
Il devrait
parler du doublement soit du nombre de chromosomes, soit de
la masse d'ADN. |
||||||||||||||||||||||||||
|
L'interprétation des résultats est tout d'abord plus compliquée que ce qui est scolairement présenté (plus haut par exemple !!!): voici 4 points
Pour ceux qui ont
accès à des publications scientifiques
payantes, une revue "moléculariste" des rôles
de la colchicine et l'accès aux
références bibliographiques est : |
|
(1) - l'organisme utilisé est la vesce: Vicia faba qui possède 12 chromosomes. (2) - la durée du cycle cellulaire de la vesce est d'abord considérée comme uniforme et égale à 24 heures, ce qui est plus ou moins remis en cause dans les résultats obtenus (il semble qu'il y ait des différences entre les cellules d'un même tissu - voir la fin de l'avant dernier paragraphe ci-dessus). (3)
- le rôle de la
colchicine
est plus complexe que je ne le pensais (je croyais savoir
qu'elle inhibait la polymérisation de la tubuline des
microtubules, empêchant ainsi le déplacement
des chromosomes et la cytodiérèse). A faible
concentration la colchicine bloque la dynamique des
microtubules (forces qui seraient engendrées par leur
déplacement ou leur
polymérisation-dépolymérisation...!).
À plus forte concentration la colchicine
empêche la formation des microtubules. En fait ses
conséquences semblent être bien plus
variées et il n'est pas excessif de penser que
l'action proposée sur la tubuline soit loin
d'être la seule
(voici
le paragraphe 1
ci-dessus):
|
|
Dans le cadre d'une interprétation moins moléculaire, le but n'est pas de rechercher les éléments complexes de contrôle qui permettent de synchroniser les différentes étapes identifiées: formation des chromosomes, attachement aux microtubules, migration, séparation, regroupement et cytodiérèse; mais de se reposer sur la dynamique (donnée comme phénomène) qui est une catastrophe de division et de rechercher les attracteurs qui pourraient être impliqués et les conflits qui généreraient les points stables, donnant naissance aux structures observées (voir quelques pistes dans la page générale sur les molécules). |
||||||||||||||||||||||||||
|
|
|
|
|
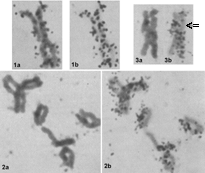
série 1 : Un chromosome à deux chromatides marquées d'une cellule à 12 chromosomes après une exposition de 10h à la colchicine. Les chromatides sont interprétées comme étant encore partiellement accolées. série 2 : plusieurs chromosomes d'une cellule à 24 chromosomes après 34h d'exposition à la colchicine; pour l'interprétation de la différence entre chromatides et chromosomes (voir plus bas) on s'appuie sur l'interprétation liée à l'ADN (ce qui est un raisonnement erroné): la forme en "étoile à 3 branches" en haut à gauche ne peut, du fait de l'hypothèse interprétative d'un marquage sur une seule chromatide, que correspondre à deux chromosomes partiellement accolés; le chromosome le plus à droite, celui du centre et celui le plus en bas, seraient des chromosomes avec deux chromatides assez bien séparées et l'une des chromatides seulement marquée; le chromosome en L ouvert correspondrait à deux chromatides d'un même chromosome largement éloignées mais réunies au sommet... série 3 : dans une cellule de la série 2 un distingue bien des zones marquées sur chaque chromatide qui semblent s'être échangées; les auteurs les interprètent comme des crossing-over qui interviendraient en prophase de MITOSE ce qui est très peu conventionnel !!!! (voir le dernier paragraphe du texte ci-dessus). Comme ces figures ont été observées uniquement pour les cellules à 24 et 48 chromosomes on peut penser que la perturbation des dynamiques qui ont conduit à cet échange est du à la colchicine et que ce n'est pas un phénomène usuel lors des mitoses. mais il y a certainement quelque chose à creuser ici.
|
||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
(4) - l'interprétation des figures métaphasiques transitoires obtenus avec de la colchicine et fixées (l'observateur ne s'intéresse qu'a cette phase qui permet de dénombrer les chromosomes et évaluer la radioactivité des chromatides séparées artificiellement par la colchicine) est aussi délicate: |
|
+ le fait qu'il y ait des cellules
à 12, 24 et 48 (rarement) chromosomes montre que le
cycle de 24 h n'est pas absolu OU que la colchicine ne
bloque pas uniformément la cytodiérèse
... Un dénombrement et une exploration du
phénomène serait bienvenu. * les cellules à 12 chromosomes sont presque toutes non marquées et sont supposées par l'auteur (paragraphe 3 ci-dessus) s'être divisées (après réplication de leur ADN en absence de précurseur isotopique), mais on peut aussi supposer qu'elles ne se sont pas divisées ou divisées sans incorporer le marqueur. Les rares qui ont incorporé le marqueur (et sur les deux chromatides) pourraient aussi bien résulter d'une non division. |
||||||||||||||||||||||||||
|
On est loin d'être sûr de la substance chimique à laquelle la radioactivié est associée. |
|
* le tritium marque la thymidine (voir extrait 1ère colonne ci-contre) qui est censée s'incorporer au chromosome. Mais sous quelle forme ? En effet, si l'on suppose que la thymidine est intégrée dans le chromosome il faut imaginer soit une voie de dégradation (fig 21-39 in Principes de Biochimie, Lehninger) suivie d'une synthèse de novo à partir de la cytidine ou de l'uridine ; soit, préférentiellement, une voie de récupération (ces voies de récupération sont beaucoup plus simples que les voies de synthèse)... On peut affirmer que le Tritium marque le chromosome; mais dire qu'il marque l'ADN paraît peu sûr; en tout cas la radioactivité pourrait très bien se retrouver au niveau de plusieurs composés. Un élément très surprenant: après la période de marquage on est surpris que les racines ne soient pas mis dans une solution IDENTIQUE MAIS NON RADIOACTIVE afin de réaliser un phénomène de "chasse". L'auteur affirme que les racines sont placées directement dans une solution minérale contenant de la colchicine (et donc sans thymidine). C'est un argument de plus pour douter de l'incorporation de la radioactivité sous forme de thymidine. |
|
|
|
|
||||||||||||||||||||||||
|
autres remarques... |
|
|
|
|||||||||||||||||||||||||||
|
|
|
* on peut noter avec quelle prudence Taylor parle de strand (brin) pour éviter de parler de la molécule d'ADN (maintenant cette terminologie est couramment employée pour parler d'une chaîne de nucléotide mais ce n'était pas le cas alors). La prudence avec laquelle il conclut son résumé est aussi remarquable (voir ci-contre le résumé et sa traduction). mais on peut aussi voir que ses hypothèses sont maintenant celles reconnues par tous. Il serait intéressant de proposer d'autres explications à ces résultats.
|
|
|
|
|
||||||||||||||||||||||||
|
Du point de vue de l'histoire des sciences...
|
|
Taylor était bien conscient qu'en comparant un chromosome de la Vesce avec l'ADN d'un phage et une molécule d'ADN comme Watson et Crick il faisait une audacieuse hypothèse (voir extraits ci-contre). Il est souvent rapporté que Meselson connaissait les résultats de Taylor au moins par celui qui l'avait "branché" sur l'ADN (Max Delbrück) (2) ce qui permet de faire des rapprochements entre les différents modèles proposés aux différentes échelles. Comment envisager ces modèles de façon plus moderne en proposant des modèles différents pour chaque échelle ? |
|
[...]
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
En travaux |
|
|
||||||||||||||||||||||||

 Un
aperçu
(très mauvaise qualité juste pour donner envie
d'aller voir
Un
aperçu
(très mauvaise qualité juste pour donner envie
d'aller voir