La reproduction est un terme qui divise encore les biologistes. Dans son acception la plus générale le mot désigne à la fois les phénomènes de croissance et renouvellement d'un organisme vivant, qui pour d'autres sont plutôt apparentés à la nutrition, alors que d'un point de vue plus restrictif la reproduction est une spécificité de l'espèce vivante, dont l'individu peut ou non faire usage. C'est ce sens qui a ma préférence. La fonction de reproduction est la troisième grande fonction du vivant, caractéristique de l'espèce (voir Qu'est-ce que la vie ?).
Le programme nous demande de traiter 3 aspects:
- l'aspect embryologique (le développement
de l'appareil reproducteur de l'homme et de la femme) et anatomique
(disposition des organes),
- ensuite l'aspect physiologique de la fonction
reproductrice (intégration aux autres fonctions:
nutrition et relation),
- enfin un aspect neurologique sur les fonctions
cérébrales associées à la
copulation.
Sexe = différence entre mâle et femelle dans le cadre de la reproduction dite sexuée (à deux individus de sexes opposés: on devrait dire de sexes complémentaires); il y a une origine anthropologique évidente au terme de sexe (du latin sexus = sexe) comme à celui de mâle (du latin masculus = mâle) et de féminin (du latin femina = la femme). Nos connaissances biologiques de l'ensemble du vivant se font par analogie et nous garderons toujours à l'esprit cette vision anthropologique.
Plan
- 1 - Devenir
homme ou femme
- 1.1 - Détermination
primaire du sexe : le sexe de la gonade
(testicule ou ovaire) est déterminé par les
chromosomes sexuels
et par les hormones
produites par ces gonades en cours de
différenciation
- 1.2 Détermination secondaire du sexe : les voies génitales et les caractères sexuels secondaires sont déterminés par les hormones sexuelles produites par les gonades
- 1.1 - Détermination
primaire du sexe : le sexe de la gonade
(testicule ou ovaire) est déterminé par les
chromosomes sexuels
et par les hormones
produites par ces gonades en cours de
différenciation
- 2 - Mécanismes
neuro-endocrines de la reproduction
- 2.1 - La production continue des spermatozoïdes par les testicules
- 2.2 - La production cyclique alternée des ovocytes II (+ GP) par les ovaires et la préparation pour la nidation et la destruction cyclique de la muqueuse utérine
- 2.3 - Le travail de reproduction transmet la vie : de la fécondation à l'autonomie de l'enfant
- 2.4 - De la maîtrise de son corps au contrôle de l'espèce
- 3 - Sexe
et cerveau
- 3.1 - Données sur le système nerveux sexuel et le système émotionnel
- 3.2 - La personne est sexuée EN TRAVAUX
- 3.3 - Une vision scientifique intégrée de la reproduction
Sources:
Biologie du développement, Scott F. Gilbert,
7°ed, 2004, De Boeck (site
associé à la 9° éd)
La reproduction des vertébrés, Thibault,
Beaumon et Levasseur, 1998, Masson
La
reproduction animale et humaine, M.Saint-Dizier et S.
Chastant-Maillard coord., Quae, 2014

Le site svtfemininmasculin.com
est à nouveau ouvert !
1 - Devenir homme ou femme
* Un développement est un
phénomène autonome qui fait passer un être
vivant d'une forme immature initiale à une forme finale
mature.
Les développements sont des stades de la reproduction.
Tout développement a une dimension évolutive.
On distingue chez l'homme 3 étapes principales de
développement:
- le développement embryonnaire qui fait
passer l'embryon stade une cellule (œuf
fécondé) au stade fœtal avec des organes
formés (d'une durée fixée arbitrairement
à 8 semaines)
- le développement post-embryonnaire ou développement
fœtal qui va du fœtus au
nouveau-né (de la 8ème semaine de vie embryonnaire
- 1ère semaine de la vie fœtale - à la
39ème semaine habituellement),
- le développement post-natal qui conduit
le nouveau-né au stade adulte (puberté, du latin pubes
=poil).
| embryon 1 ¢ Ø = 120 µm |
>>>>>> | >fœtus
L < 30 mm |
>>>>>> | nouveau-né
L = 50 cm |
>>>>>> | adulte homme ou femme
|
| développement
embryonnaire (8 semaines) |
|
|
|
|
||
| |
|
développement
post-embryonnaire (développement fœtal) (31 semaines) |
|
|
||
| |
|
|
|
développement post-natal | ||
La vie embryonnaire (et post-embryonnaire) commence
à la fécondation et dure donc de façon
extrêmement régulière 39 semaines
(dites semaines de grossesse ou de gestation (SG)).
39 semaines de grossesse = 8 semaines de vie embryonnaire + 31 semaines de vie fœtale.
On parle parfois (pas ici) de semaines d'aménorrhée (SA) pour désigner les semaines depuis les dernières règles (du grec "méno" = menstruations = règles, et "rhéo " = flux, "a" étant le privatif = non), l'âge du nouveau-né est alors habituellement de 41 semaines d'aménorrhée.
* Depuis Weisman on distingue les cellules somatiques des cellules germinales. Le soma c'est le corps - les cellules somatiques perdent les caractéristiques de l'espèce - et le germen ce qui est transmis - les cellules germinales conservent les caractéristiques de l'espèce pour les transmettre.
La théorie du plasma germinatif, élaborée expérimentalement, indépendamment, par les biologistes allemands August Weismann (1883) et Wilhelm Roux (1888), a été formalisée dans l'ouvrage de Weismann publié en 1892 et intitulé Das Keimplasma. Eine Theorie der Vererbung (traduit en anglais en 1915, Germ Plasm : a Theory of Heredity). C'est une théorie du développement embryonnaire qui postule que, puisque les chromosomes sont les vecteurs de l'hérédité et que l'ovule et le spermatozoïde contribuent à la constitution chromosomique de l'embryon, alors les cellules germinales (le germen, à l'origine des cellules sexuelles ou gamètes), qui assurent la transmission des caractères de l'espèce, doivent conserver la totalité de l'information contenue dans le noyau de l'œuf fécondé. Cette information serait, en revanche, irréversiblement perdue au cours de la différenciation des autres cellules (le soma) qui sont responsables de la construction de l'organisme adulte. Cette théorie conduisait au rejet définitif de la transmission des caractères acquis (pas d'influence du soma sur le germen) mais elle admettait une instabilité génétique résultant, à chaque génération, des apports parentaux (d'où réassortiments germinaux modifiant le soma).
MAIS...
Le clonage par transfert de noyaux a permis de démontrer
que la différenciation des cellules somatiques
résulte du fonctionnement différentiel de
l'activité des gènes et non de leur
élimination par modifications structurelles du noyau au
cours des nombreuses divisions successives.
En revanche, on sait maintenant, depuis la naissance de la
brebis Dolly - premier mammifère cloné - que cette
différenciation nucléaire peut être
réversible puisque cet animal a
été obtenu à partir d'un noyau issu d'une
cellule somatique (en l'occurrence, une cellule mammaire).
Cette théorie demanderait donc à être
fortement modifiée.
* La détermination du sexe est habituellement séparée en deux étapes :
- la détermination primaire du sexe qui est en fait la transformation de la gonade indifférenciée de l'embryon en gonade sexuée qui produit des hormones sexuelles : on considère que ce déterminisme est chromosomique et génétique même si, malgré les progrès de la biologie moléculaire, on peut encore dire (avec Gilbert, Biologie du développement, 7°éd. 2004, p 556) « nous ignorons toujours la fonction des gènes de détermination des ovaires et des testicules, et le problème de la détermination primaire du sexe demeure l'une des grandes questions sans réponse de la biologie».
- la détermination secondaire du sexe
comporte la mise en place des voies génitales et organes
génitaux externes ainsi que le développement ce
que l'on appelle les caractères sexuels secondaires (voix
et développement des cartilages œsophagiens,
pilosité, répartition des masses graisseuses,
taille...). On considère que cette détermination
est hormonale sous le contrôle des hormones sexuelles
sécrétées par les gonades
différenciées. Elle se passe en deux étapes
: lors du développement fœtal et lors du
développement post-natal, à l'adolescence.
En absence de gonades différenciées, les voies
sont féminines.
1.1 - Détermination primaire du sexe : le sexe de la gonade (testicule ou ovaire) est déterminé par les chromosomes sexuels et par les hormones produites par ces gonades en cours de différenciation
1.1.1 - Deux chromosomes sexuels
La cellule œuf ou embryon au stade 1 ¢ peut posséder deux caryotypes différents au niveau de la paire de chromosomes n°23 (hétérochromosomes ou gonosomes): XX ou XY. Ce caryotype oriente le sexe de l'individu. XX femelle, XY mâle
Si le X vient toujours de la cellule sexuelle femelle (ovocyte), le chromosome sexuel déterminant, X ou Y vient du spermatozoïde. On peut donc dire que c'est le père qui détermine le sexe chromosomique de l'embryon.
La faible différence du contenu chromosomique des spermatozoïdes X et Y permet de les séparer et donc de les trier (par cytométrie de flux avec un colorant ; la méthode étant imparfaite avec un taux de réussite de 90%).
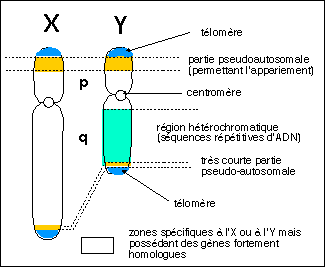
Si l'on compare les chromosomes X et Y on observe que le chromosome X possède tout d'abord une grande région avec de l'ADN répété (sans gènes, région dite hétérochromatique) qui occupe la majorité du bras long. Chaque extrémité (télomère) est suivie par une région pseudo-autosomale (pratiquement identique entre l'X et l'Y).
Remarque : il existe de très nombreuses espèces - y compris de vertébrés -- chez lesquelles la présence de chromosomes sexuels n'a pu être mise en évidence (reptiles (tous les crocodiliens, nombreuses tortues, quelques lézards), amphibiens (plus de 99%), poissons (la plupart)).
1.1.2 - Théorie chromosomique
Le déterminisme de la différenciation
sexuelle de l'appareil génital au cours du
développement est considéré de
façon évidente comme chromosomique. XX ->
femelle, XY -> mâle.
Si l'on s'intéresse à son histoire, elle permet de mettre en évidence deux grandes périodes de l'histoire de l'hérédité (voir Expliquer la vie d'André Pichot, page hérédité) : le passage d'une hérédité protéique à une hérédité génique.
On s'est rapidement rendu compte que l'un des chromosomes sexuels X est inactivé au cours du développement embryonnaire des mammifères femelles. On pense que c'est pour maintenir le même niveau d'expression chez les mâles et femelles !!!
Tant que
l'on n'a pas de modèle clair de la liaison entre le
caryotype et le sexe on en est réduit à des
idées simplistes. Les anomalies caryotypiques ne
simplifient pas les choses.
Les premières anomalies caryotypiques sont des monosomies
(1) ou des trisomies (3) pour lesquelles les
caractéristiques des gonades s'expliquent assez
simplement par un excès ou un déficit
chromosomique sans que l'on comprenne vraiment le rôle de
chaque chromosome. On notera cependant que ces anomalies
s'accompagnent presque toujours d'autres troubles que ceux de la
fonction sexuelle.
Comme il existe des cas (4) d'anomalies où des individus avec un caryotype XX ont des testicules et avec un caryotype XY des ovaires, on a cherché, dans le cadre de la théorie chromosomique à expliquer ces anomalies à l'aide de translocations ou de délétions. L'idée étant d'expliquer la masculinisation par la présence d'une petite portion du Y, seule nécessaire, qui pouvait être transloquée ou délétée. Les expériences étant menées chez la souris.
| |
caryotype | morphologie et anatomie | gonades | remarques |
| 0 | 22x2 + XX | féminine | ovaires fonctionnels | |
| 0 | 22x2 + XY | masculine | testicules fonctionnels | |
| 4 | 22x2 + XX | masculine | testicules fonctionnels | translocation des segments du chromosome Y sur un X modifié |
| 4 | 22x2 + XY | féminine | gonade hermaphrodite | déletion d'une partie du chromosome Y |
| 1 | 22x2 + X (noté XO) monosomie |
féminine | différenciation puis régression des ovaires |
syndrome de Turner (nanisme, impubérisme,
stérilité), 1/2700
autres troubles graves |
| 3 | 22x2 + XXX
trisomie |
féminine | ovaires fonctionnels | 1/500, fertilité
normale
autres troubles graves |
| 3 | 22x2 + XXY
trisomie |
masculine | petits testicules non fonctionnels | syndrome de Klinefelter
(stérilité), 1/700
autres troubles graves |
| 3 | 22x2 + XYY
trisomie |
masculine | testicules fonctionnels | 1/500, fertilité
normale
autres troubles graves |
- Ces anomalies chromosomiques se retrouvent chez une vingtaine d'espèces de Mammifères, mais avec des conséquences variables. Des souris XO se reproduisent normalement par exemple.
- Aucune monosomie ni trisomie n'existe sans l'apparition de troubles plus ou moins graves qui ne sont généralement pas limités à la fonction sexuelle.
- Les phénotypes sont VARIABLES pour un même caryotype.
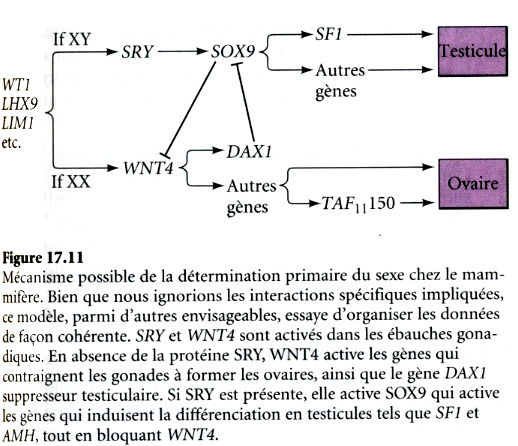
Image provisoire extraite de Biologie du
développement
Remarque:
je n'ai pas trouvé de convention globale pour l'écriture des gènes et de leurs produits. Sous réserve, voici quelques affirmations peut-être inexactes...
- Les gènes sont censés être écrits en italiques, au moins pour la levure. Ils commencent par une majuscule s'ils sont considérés comme ayant un mode de transmission dominant (et une minuscule s'ils sont considérés comme récessifs).
- Les protéines sont écrites en lettres droites, majuscules pour certains organismes (pour la levure on place un Y pour yeast au début...).
En conclusion :
Chez les mammifères thériens (marsupiaux et placentaires – quelques exceptions connues chez des rongeurs comme la souris naine africaine ) un seul gène est NÉCESSAIRE et SUFFISANT pour induire la différenciation de la gonade en testicule : le gène SRY (Sex-determining Region of the Y). Chez les vertébrés de très nombreux gènes qui joueraient le même rôle ont été découverts (gènes peu conservés au cours de l'évolution, alors que les gènes permettant la synthèse des stéroïdes sont très conservés).
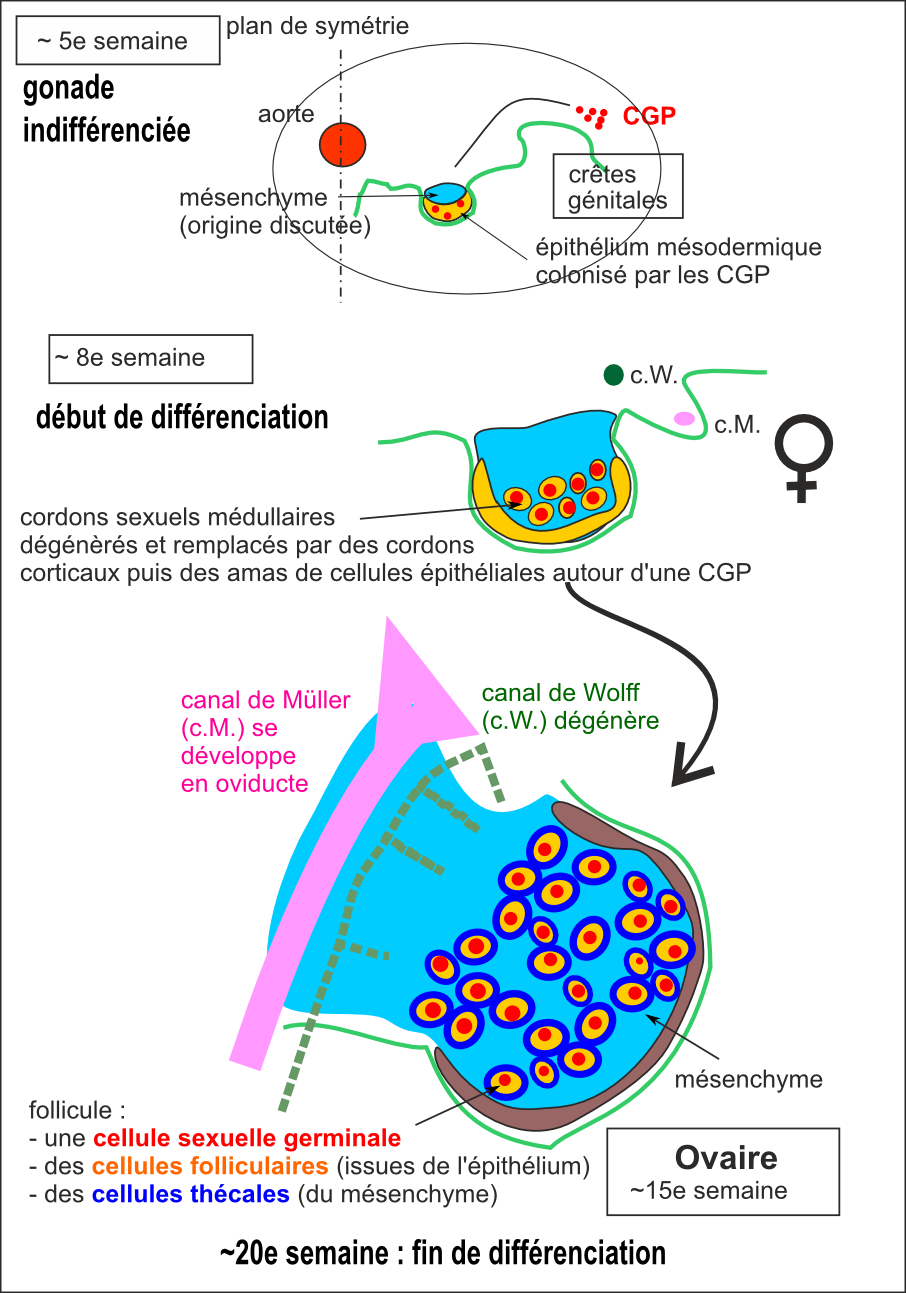
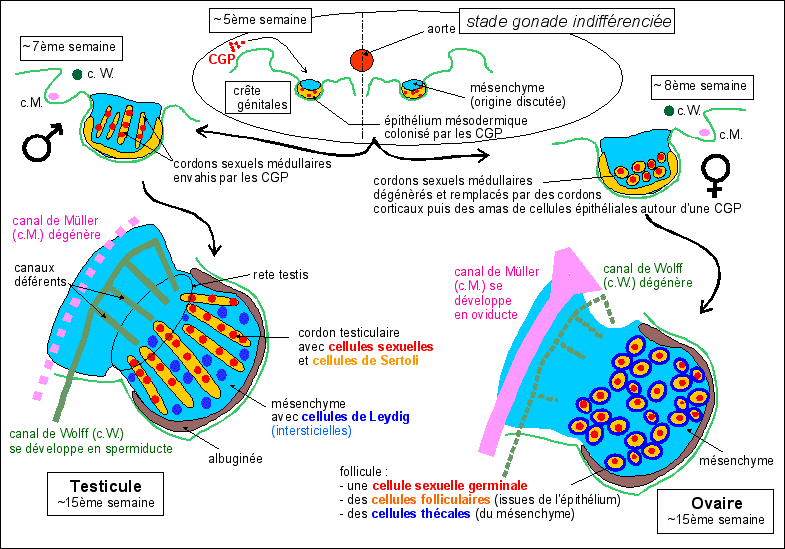
La gonade indifférenciée évolue en testicule dès la 6e-7e semaine (apparition des cordons sexuels médullaires à partir de l'épithélium – futures cellules de Sertoli) alors qu'elle attend la 8e semaine pour évoluer en ovaire (cordons sexuels médullaires dégénèrent et forment des amas de cellules épithéliales, futures cellules folliculaires).
C'est l'expression du gène SRY dans les cellules de Sertoli (et uniquement dans ces cellules chez la souris) qui active la transformation de ces cellules (et l'expression du gène SOX9) et la synthèse de substances paracrines qui dirigent la transformation de la gonade.
Remarque : on a pris la mauvaise habitude de présenter dans les manuels scolaires un phénomène totalement imaginaire : on aurait une gonade totalement indifférenciée jusqu'à la 5e semaine et puis brutalement, suite à l'activation du gène SRY, une gonade qui s'orienterait vers dans une voie testiculaire vers la 6e – 7e semaine. Par défaut cette voie serait féminine. On confond l'aspect morphologique indifférencié avec la différenciation anatomique et surtout cellulaire. En effet, les cellules (futures Sertoli notamment) commencent leur différenciation en fonction du sexe (par activation du gène SRY notamment et surtout des produits de gènes connexes) même avant la colonisation des crêtes par les PGC. De même il existe de nombreux gènes qui sont activées pour le voie ovarienne, ce n'est pas qu'une voie passive, par défaut. On peut suspecter une certaine récupération idéologique, probablement souvent inconsciente, qui tendrait à confirmer que l'on naît asexué et que le sexe se construit le plus tardivement possible....
1.1.3 - Théorie de l'information génétique
L'idée d'un unique
gène sexuel (SRY :
sex-determining region of the Y)
sécrétant un produit unique (le TDF : testicule
differenciation factor) n'est qu'un leurre. Les
gènes impliqués dans la différenciation
de la gonades sont très nombreux et forment un
réseau complexe qui est loin d'être
élucidé.
Avec l'avènement de la théorie de
l'information génétique on a cherché non
plus un locus chromosomique, mais directement un gène et
un produit : cette fois c'est une molécule
protéique, produite par un gène
moléculaire, qui a les propriétés
masculinisantes (le TDF : testicule Différenciation
Factor).
On peut considérer que cette étape, a vu son couronnement en 1991 avec l'expérience de Koopman. Il obtint des souris transgéniques XX mais avec des testicules. Koopman et ses collaborateurs avaient inséré un segment d'ADN de 14kb contenant le gène Sry (Sex-determining Region of the Y : région de détermination de l'Y) par micro-injection dans les noyaux des zygotes (cellule fécondée). Certains zygotes ont donné des souris transgéniques vivantes XX avec des testicules. Cette recherche de la région du TDF (testicule détermination factor) aura duré 50 ans.
Le gène sry de la souris est appellé SRY chez l'homme. Depuis, de nombreux gènes, dont certains situés sur les autosomes (chromosomes non sexuels) ont été trouvés.
On se gardera donc de présenter un modèle
définitif d'une détermination
génétique primaire du sexe.
(Les exercices scolaires
présentés dans les manuels et demandant aux
élèves un raisonnement simpliste du type :
gène SRY activé donc mâle, pas de SRY donc
femelle... dépassent donc nettement les connaissances
scientifiques avérées, sauf si ces
éléments étaient présentés
comme des modèles simplifiés historiques...).
Ni la théorie chromosomique ni la théorie de l'information génétique ne donnent une explication satisfaisante du détermisme primaire du sexe qui reste une question ouverte.
On en revient donc toujours au problème central de
la génétique : plus on creuse, plus on renforce
l'idée que le
gène est une séquence d'ADN qui code pour un
produit (ARN et/ou protéine), mais
pas pour une structure.
La méthode de sélection-mutation
échoue totalement à trouver une fonction à
un gène qui ne soit pas
prédéterminée par la méthode : on ne
sélectionne que des individus présentant la
modification souhaitée dans le cadre de
l'interprétation posée comme principe à
l'expérience : on ne prouve rien si ce n'est qu'un
organisme modifié génétiquement peut
effectivement présenter certaines différences
génétiques en même temps que certaines
différences anatomiques ou physiologiques ; mais le lien
de causalité est rompu du fait de la sélection.
1.1.4 - Différenciation de la gonade et rôle des
hormones
1.1.4.1 - Aspects histologiques
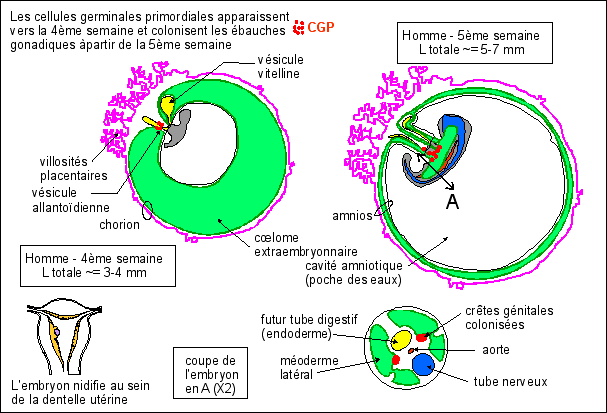
Chez l'homme l'ébauche gonadique apparaît à la fin de la 4ème semaine de gestation au niveau de crêtes génitales qui se forment à partir du feuillet interne du mésoderme latéral (le feuillet intermédiaire entre l'ectoderme, externe, qui donne aussi le tube nerveux par invagination, et le feuillet interne endodermique, qui donne le tube digestif). Les crêtes génitales, au niveau de deux légers bombements de l'épithélium cœlomique dorsal, sont allongées au contact de la face interne du mésonéphros, de part et d'autre de la racine du mésentère dorsal.
+La gonade comprend deux types de cellules :
- des cellules germinales (sexuelles) issues
de cellules germinales primordiales (CGP)
venant d'une zone extra-embryonnaire issue du
feuillet interne (endoderme) de l'embryon.
- des cellules somatiques (du grec "soma"
= corps) venant du feuillet
intermédiaire (mésoderme) de
l'embryon.
+ L'origine des cellules germinales primordiales (CGP) est endodermique et extra-embryonnaire: elles apparaissent vers la 5ème semaine de vie embryonnaire (stade bourgeon caudal) au niveau de l'endoderme (le tissu qui englobe la vésicule vitelline) au voisinage du pédicule allantoïdien qui participera au cordon ombilical. Les quelques 30 à 50 cellules germinales primordiales se distinguent à peine des cellules endodermiques. Elles commencent à migrer à la fin de la 5ème semaine et colonisent les crêtes entre la fin de la 5ème semaine et le début de la 6ème.
+ L'origine des cellules somatiques participant à l'élaboration de la gonade (cellules épithéliales et mésenchyme) divise encore les biologistes.
La gonade indifférenciée
comporte deux parties :
* l'épithélium avec les cellules germinales ;
les cellules germinales peu nombreuses (quelques milliers) se
divisent rapidement dans l'épithélium
des crêtes en même temps que
celui-ci prolifère, devient stratifié et
émet quelques courts cordons en direction du mésonéphros
(stade de l'appareil urinaire embryonnaire). La taille de
l'ébauche gonadique s'accroît, les crêtes se
raccourcissent et bombent dans la cavité cœlomique.
Une basale commence à se différencier entre
l'épithélium cœlomique et le
mésenchyme sous-jacent qui ne sera achevée
qu'après la différenciation sexuelle.
* le mésenchyme ;
entre l'épithélium des crêtes
génitales et l'ébauche du
mésonéphros se met en place un blastème
mésenchymateux à l'origine des
cellules somatiques de la gonade. Bien que ces cellules jouent
un rôle capital dans la gamétogénèse,
leur provenance est un problème non résolu.

Les cellules germinales se distribuent à peu près symétriquement entre les crêtes gauche et droite. Il semble bien que les cellules germinales qui colonisent les crêtes germinales avant la période de différenciation gonadique différent déjà par des caractères cytologiques (densité en réticulum endoplasmique, mitochondries, particules de glycogène, gouttelettes lipidiques) selon le sexe génétique [i.e. chromosomique] de l'embryon.
|
Expérience: |
Remarque:
On notera que l'embryon au sens strict (qui comprend des
tissus qui feront partie du fœtus puis du nouveau-né)
est très réduit par rapport à la
masse de tissus extraembryonnaires (puis extra-foetaux).
Le placenta est mixte (materno-fœtal).
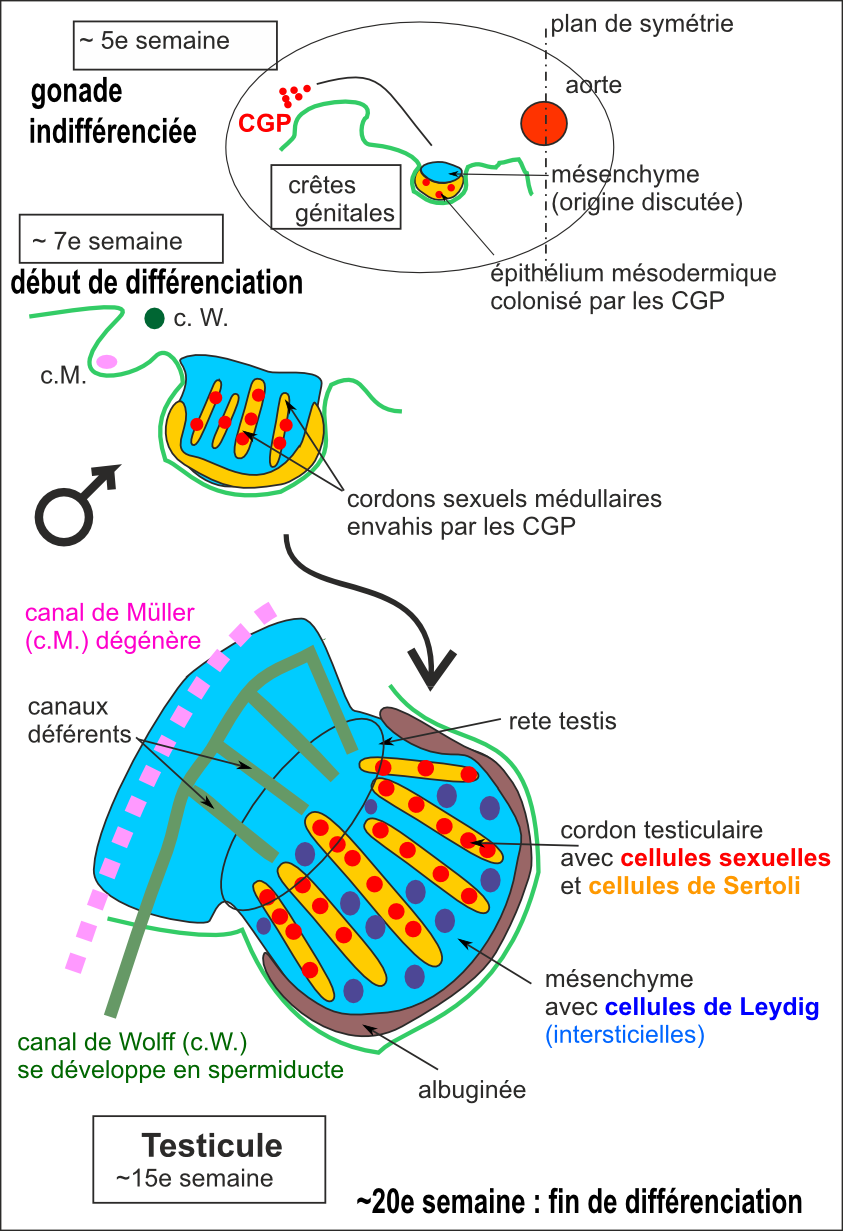
Jusqu'à la 6ème semaine embryonnaire, la gonade est morphologiquement indifférenciée (présence de cordons sexuels primaires). À la 7ème semaine pour le testicule (développement des cordons primaires en cordons sexuels colonisés par les CGP) et à la 8ème semaine pour l'ovaire (dégénérescence des cordons sexuels primaires puis formation d'amas) la gonade a pris une direction clairement visible.
On peut considérer que les gonades sont histologiquement complètes vers la 20ème semaine.
|
|
|
|
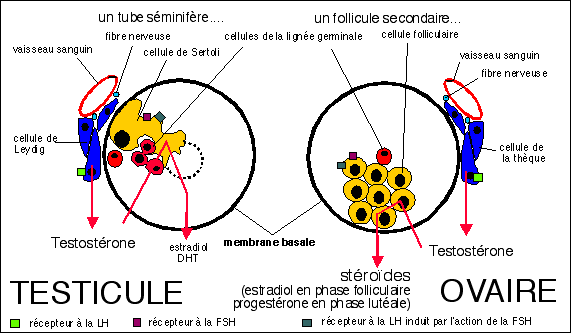
Homologies entre cellules (et tissus) de la
gonade mâle et femelle; |
|||
|
mésenchyme |
cellules de Leydig |
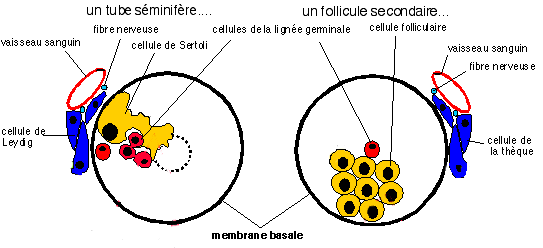 Comparaison d'un tube séminifère testiculaire et d'un follicule ovarien : (les couleurs sont les mêmes que celles des schémas sur le développement de la gonade ci-dessus afin de montrer l'origine embryonnaire commune des cellules) |
cellules thécales |
|
cellules de l'épithélium mésodermique des crêtes génitales |
cellules de Sertoli |
cellules folliculaires |
|
|
cellules de la lignée germinale (CGP) |
cellules sexuelles : spermatides et spermatozoïdes |
cellules sexuelles : ovocytes |
|
1.1.4.2
- Aspects physiologiques
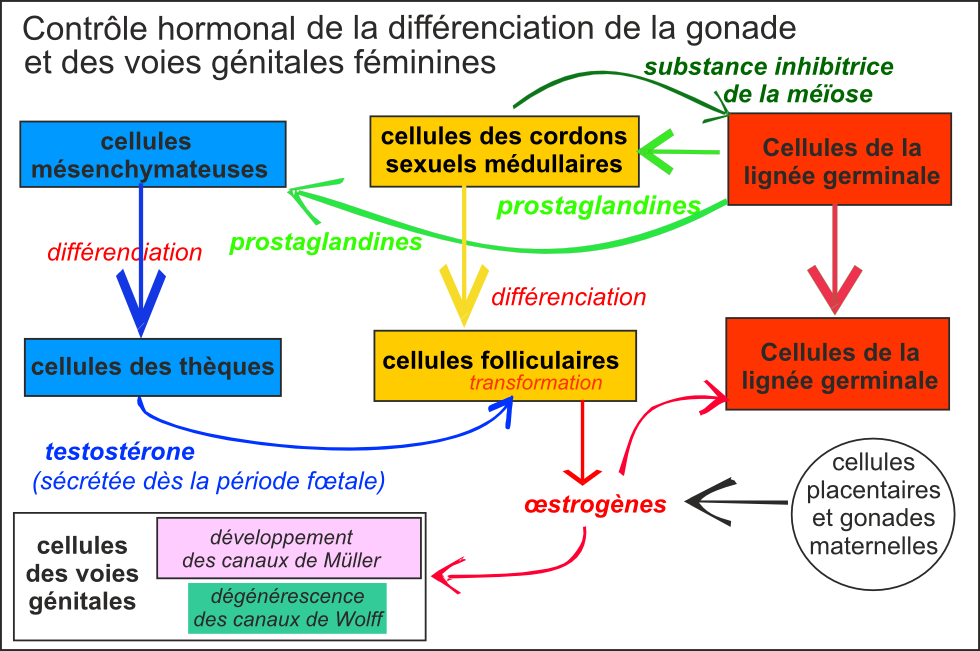
À partir de la 8ème semaine, la différenciation de la gonade et la différenciation des voies génitales se font sous contrôle hormonal.
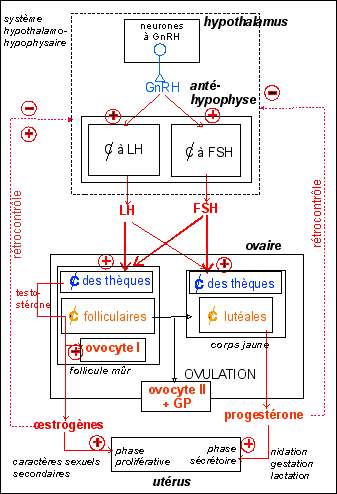
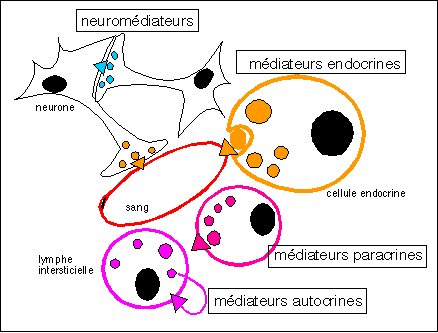
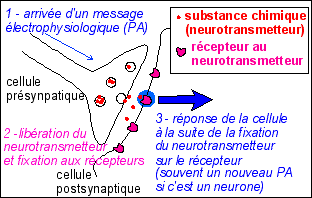
Une hormone est une substance chimique sécrétée par des cellules spécialisées (cellules endocrines), libérée dans et transportée par le sang, qui agit sur des cellules cibles pourvues de récepteurs spécifiques.
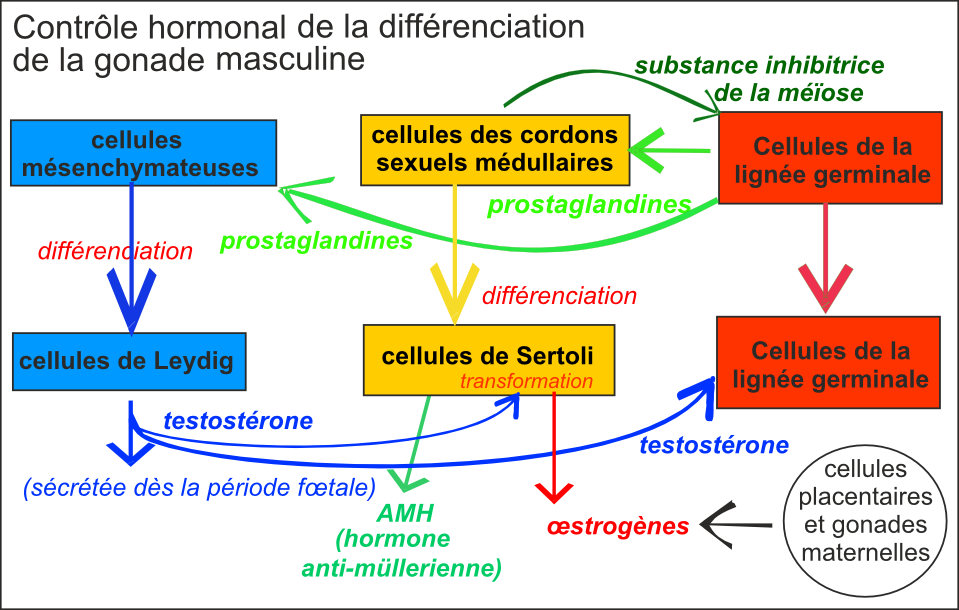
Gonade masculine :
Les cordons sexuels prolifèrent jusqu'à la
8ème semaine, s'étendant profondément dans
le tissu conjonctif. La partie distale (médulla) est
composée de cordons plus minces et forme le rete
testis. Les cordons perdent leur contact avec
l'épithélium de surface (cortical) qui
s'épaissit et forme l'albuginée. Les
cellules des cordons sécrètent une substance
inhibitrice de la méïose qui bloque la
différenciation des cellules germinales qui, en retour,
secrètent des prostaglandines qui induisent la
différenciation des cellules des cordons en cellules
de Sertoli. Les cellules de Sertoli
sécrétent l'hormone antimüllerienne (AMH).
Les cellules mésenchymateuses interstitielles des
testicules ont formé les cellules de Leydig
qui produisent la testostérone dès la
période fœtale.
Chez les mammifères, il existe 2 populations de cellules de Leydig : les cellules de Leydig fœtales venant du mésenchyme des crêtes génitales, disparaissant à la naissance et produisant la testostérone qui permet la différenciation de l'appareil génital mâle ; et les cellules de Leydig adultes, d'origine interne au testicule (cellules fusiformes du tissu interstitiel) qui sont contrôlent la spermatogénèse, l'apparition et le maintien des caractères sexuels secondaires.
Les cellules germinales primordiales se
différencient en cellules sexuelles de type
spermatogonies (type A1 ou cellule souche) qui
n'évoluent pas depuis la 20e semaine jusqu'à la
puberté. Ce n'est qu'à la puberté que les
cordons se creusent pour donner les tubes
séminifères
(info à vérifier), les cellules
sexuelles de type spermatogonies migrant à la
périphérie où elles se divisent puis se
différencient en spermatocytes (I puis II), spermatides
puis spermatozoïdes au cours des cycles sexuels
(typiquement de 74 j au sein d'une hélice de maturation
dans un tube séminifère).
Le cellules de la lignée germinale en cours de maturation
exercent une inhibition (par l'intermédiaires de
substances chimique de type paracrine) de la
sécrétion d'AMH par les cellules de Sertoli. La
baisse de la sécrétion d'AMH chez l'adolescent est
un bon indicateur du début de la pubrté.
eLes cycles sont continus de la puberté à la mort
et simultanés en de nombreux point des nombreux tubes
séminifères.
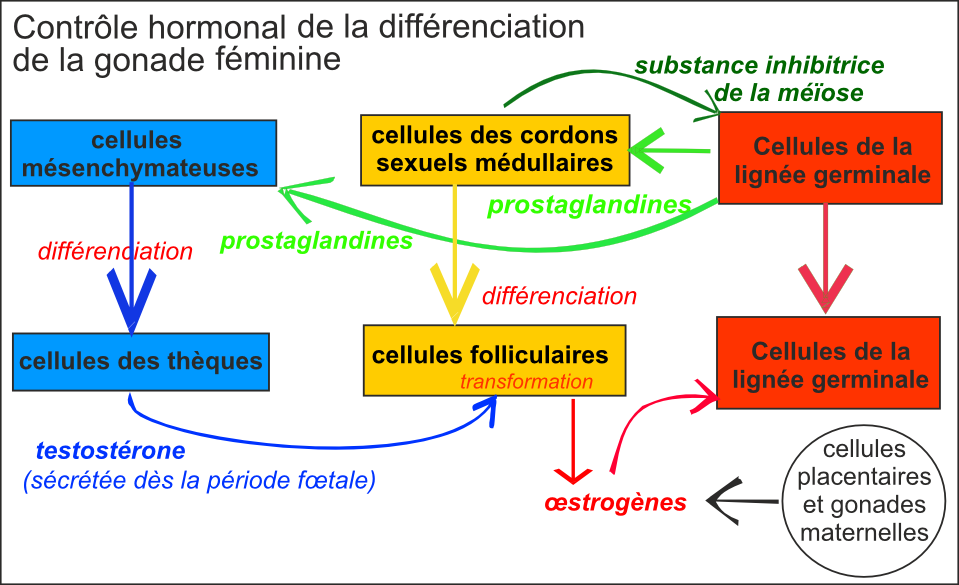
Gonade féminine :
Les cellules germinales restent près de
l'épithélium de surface. Les premiers cordons
sexuels dégénèrent, mais sont
remplacés par d'autres produits par
l'épithélium, mais qui restent en surface : cordons
corticaux. Ils se fragmentent en amas (follicule)
entourant chacun une cellule germinale. Les cellules germinales
donneront les ovocytes, les cellules des cordons les cellules
folliculaires de la granulosa et les
cellules mésenchymateuses forment des thèques,
limite externe de chaque follicule.
Il n'y a pas sécrétion d'AMH pendant la
période fœtale. La testostérone
sécrétée par les cellules thécales
lors de la période fœtale est immédiatement
transformée en autres stéroïdes
(œstradiol et progestérone) par les cellules
folliculaires. Ces hormones interviennent dans la
féminisation des voies génitales.
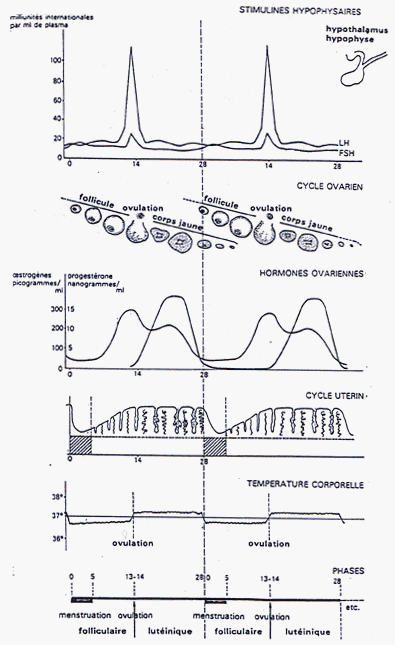
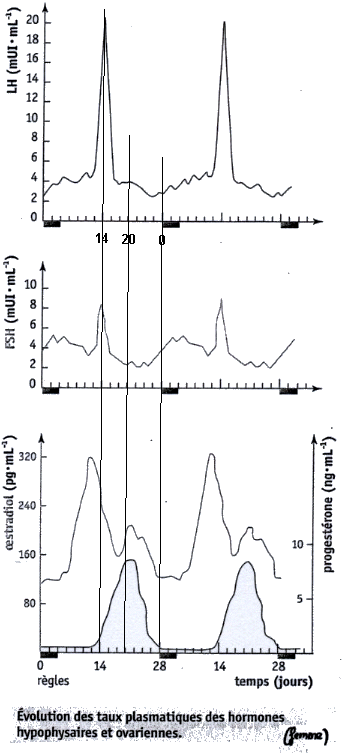
Les cellules sexuelles femelles issues de la maturation des cellules germinales primordiales sont des ovocytes I (stade prophasique de la 1ère division de méiose - voir cours de Terminale - la méiose est donc commencée et bloquée dans toutes les cellules sexuelles féminines...) depuis la 20e semaine (5e mois) jusqu'à la puberté. Entre la puberté et la ménopause de nombreux follicules (environ 600) commencent une maturation qui se termine pour un seul follicule à la fois par le stade follicule mûr (ou follicule de De Graaf) qui entoure un ovocyte qui a redémarré sa méiose pour se terminer au stade ovocyte II (avec émission d'un globule polaire) juste au moment de l'ovulation. Le follicule qui a ovulé termine sa vie par le stade corps jaune. L'ensemble d'un développement folliculaire mené à terme dure environ 4 mois avec une persistance plus longue du corps jaune, très longue s'il y a gestation. Il y a alternance des cycles entre chaque ovaire qui produit un ovule (ococyte II) tous les deux cycles de ~28 jours (ce qui correspond au cycle utérin - voir ci-après).
On peut se demander comment un fœtus qui baigne dans
les œstrogènes maternels féminisant peut se
développer en fœtus mâle. En fait les
concentrations en testostérone sont bien plus
élevées qu'en œstrogènes (voir ci-dessous).
1.2 Détermination secondaire du sexe : les voies génitales et les caractères sexuels secondaires sont déterminés par les hormones sexuelles produites par les gonades
1.2.1 - Étapes du développement des voies génitales
Chez l'embryon de tous les Vertébrés, un double système d'évacuation des gamètes (cellules sexuelles) se met en place chez l'embryon et habituellement un seul persiste chez l'adulte. Le canal de Wolff est un canal excréteur qui permet l'évacuation des déchets chez l'embryon dans la cavité du cœlome extraembryonnaire. Il est doublé par le canal de Mülller.
Pendant la période fœtale un rein se forme
à partir de la partie la distale de l'appareil
embryonnaire excréteur (métanéphros), il
communique avec l'extérieur (cavité amniotique)
par l'intermédiaire d'un nouveau canal qui le relie
à la vessie: l'uretère.
La partie médiane de l'appareil excréteur
embryonnaire (mésonéphros) correspond à la
position de la gonade, mais seuls persistent les canaux
efférents et le canal
de Wolff chez le mâle, le canal
de Müller dégénérant (disparu à
la 20ème semaine). Les canaux efférents sont en
continuité avec les tubes séminifères
creusés dans les cordons testiculaires. Ils donnent
l'épidydime et le canal déférent
(spermiducte).
Chez la femelle le canal de Wolff
dégénère et c'est au contraire le canal
de Müller qui se
développe. Chaque canal s'élargit en pavillon
au contact de l'ovaire et donne la trompe de Faloppe, l'utérus
(qui est unique par fusion des deux canaux de Müller chez
la femme, mais qui peut être double (lapine, ratte...) ou
bicorne (hamster...), et le vagin (très
généralement simple comme chez la femme).
Moyen mnémotechnique :
MLF - WOM
(c'est le canal de MüLler
qui se développe chez la Femme
c'est le canal de Wolff qui se développe chez l'hOMme)
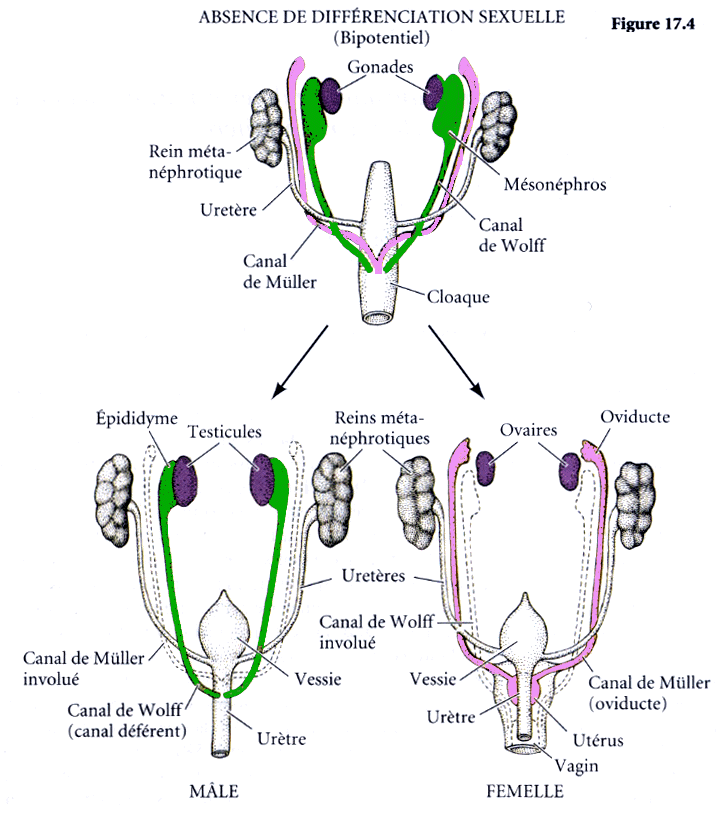
Fig 17-4 de Biologie du développement,
colorée différemment.
Les reins sont issus de la partie distale (métanéphros ) du système excréteur embryonnaire. La partie (centrale) mésonéphrotique n'étant à l'origine que des canaux efférents qui donneront l'épididyme. Les canaux de Wolff et de Müller suivent un trajet identique. La dégénérescence est lente et il faut attendre la 20ème semaine pour qu'une seule paire de canaux persiste.
1.2.2 - Contrôles hormonaux fœtaux et prépubertaires
Expérience:
Dès 1953 Jost a montré que chez des
lapins dont les gonades sont enlevées avant
la différenciation sexuelle la
différenciation des conduits et organes
génitaux est toujours femelle, quel que soit
le caryotype. Les canaux de Müller se
développent alors que les canaux de Wolff
dégénèrent. On peut
également observer ce phénomène
chez les humains qui naissent sans gonades
fonctionnelles.
voir TD -Hormones stéroïdes et des prostaglandines
Pour des données sur les taux de
stéroïdes qui semblent exactes voir Wikipédia
L'AMH (hormone anti-müllerienne) est une
hormone glycoprotéique (secrétée par les
cellules de Sertoli) qui provoque la
dégénérescence des conduits de Müller.
Cette hormone fait partie des TGF-ß (facteurs
de croissance et de différenciation). Elle se lierait aux
cellules mésenchymateuses entourant les canaux de
Müller et provoquerait la sécrétion d'un
facteur paracrine provoquant l'apoptose des cellules
épithéliales de ce canal. (référence
Uniprot
P03971  -
aucun
modèle complet des 560aa
-
aucun
modèle complet des 560aa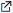 )
)
La testostérone (sécrétée par les cellules de Leydig et les cellules thécales) provoque la différenciation des conduits de Wolff en épididyme, canal déférent et vésicules séminales, transforme les bourrelets génitaux en scrotum et le tubercule génital en pénis. Chez l'homme, une partie de la testostérone est convertie en DHT et en œstrogènes par les cellules de Sertoli. Chez la femme la testostérone est presque totalement convertie en œstrogènes par les cellules folliculaires.
Cependant, on pense que c'est la DHT (5alpha-dihydrotestostérone ou androstanolone) qui serait responsable des transformations des organes reproducteurs externes (scrotum, pénis). Elle est produite par les cellules de Sertoli à la puberté, mais chez le fœtus par des cellules externes à la gonade (cellules du sinus uro-génital, renflements génitaux,...)
Les œstrogènes (= estrogènes : œstrone = estrone, œstradiol = estradiol et œstriol = estriol) sont nécessaires au développement des canaux de Müller et de Wolff. Les œstrogènes fœtaux semblent suffire à la différenciation des canaux de Müller en oviducte, utérus et col utérin. La plupart des œstrogènes sont issus de la conversion de la testostérone, aussi bien par les cellules des gonades (Sertoli et folliculaires) que par des cellules du placenta, du foie ou d'autres tissus.
Expérience:
Des souris femelles chez qui on inactive les
récepteurs aux œstrogènes voient
leurs cellules germinales mourir et les cellules
folliculaires se transformer en cellules de Sertoli.
La formation du sperme est sous le contrôle des
œstrogènes (réabsorption d'eau au niveau du
rete testis). La concentration en œstrogènes est
supérieure au niveau du rete testis que dans un ovaire.
Les œstrogènes contrôlent aussi le développement des caractères sexuels secondaires chez la femme, notamment le développement des mamelles (seins).
Deux types d'hormones selon leur mode d'action sur leurs
cellules cibles :
|
C'est la testostérone et l'AMH fœtaux qui sont responsables de la masculinisation des voies génitales alors que ce sont les œstrogènes fœtaux, mais aussi maternels et placentaires qui sont responsables de la féminisation des voies génitales femelles. |
La différenciation des canaux permettant l'évacuation des cellules sexuelles vers l'extérieur est contrôlée par les hormones de la gonade, mais pas uniquement, il ne faut pas oublier que les hormones placentaires (un tissu mixte materno-fœtal) et maternelles (qui passeraient la barrière placentaire).
Les hormones sexuelles de la période fœtale (sexualisation de l'organisme)
| hormone | nature chimique | cellules sécrétrices | période | cellules cibles |
| AMH (hormone anti-müllerienne) |
glycoprotéine | cellules des cordons
médullaires |
fœtale (8e-20e semaine) |
cellules des voies génitales, principalement cellules des canaux de Müller (ou cellules mésenchymateuses entoutant les canux de Müller) |
| DHT (dihydrotestostérone) |
stéroïde
androgène (dérivée du cholestérol) |
cellules cellules épithéliales des
cordons médullaires devenant les cellules de
Sertoli
synthèse par transformation de la testostérone |
fœtale jusqu'à la mort (avec taux variables) | cellules sexuelles et cellules des voies génitales |
| testostérone |
stéroïde androgène (dérivée du cholestérol) |
cellules
mésenchymateuses interstitielles devenant cellules
de Leydig
|
fœtale jusqu'à la mort (avec taux variables) | cellules Sertoli mais aussi
cellules sexuelles, cellules des voies génitales...
transformée dans de nombreuses cellules cibles en œstrogènes |
| cellules
mésenchymateuses interstitielles devenant les cellules
thécales des follicules
|
fœtale jusqu'à la mort (avec taux variables) | cellules folliculaires mais
aussi cellules sexuelles, cellules des voies
génitales...
transformée dans de nombreuses cellules cibles en œstrogènes |
||
| œstrogènes |
stéroïdes œstrogènes (dérivées du cholestérol) |
cellules
épithéliales des cordons médullaires
devenant les cellules de Sertoli
synthèse par transformation de la testostérone ou d'autes androgènes |
fœtale jusqu'à la mort (avec taux variables) | cellules des gonades et des voies génitales, très nombreuses cellules de l'organisme |
| cellules
épithéliales des cordons corticaux devenant
les cellules folliculaires synthèse par transformation de la testostérone ou d'autres androgènes cellules placentaires et folliculaires maternelles |
fœtale jusqu'à la mort (avec taux variables) |
Fonctionnement hormonal à la puberté:
Quelques documents plus précis sur
l'apparition de la puberté et les moyens de la mettre en
évidence (INRP
- Acces Biotic )
)
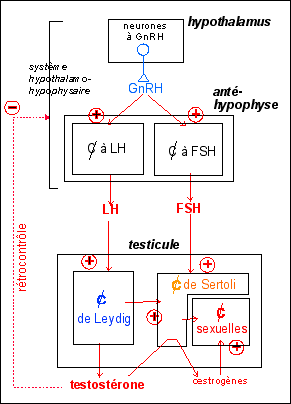
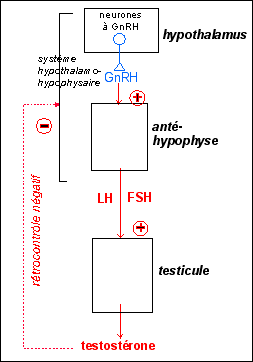
Les caractères sexuels secondaires ne sont que la face apparente et terminale du développement progressif de l'ensemble des organes au cours de la période prépubertaire; les hormones sexuelles (principalement testostérone et œstrogènes) intervenant sur de très nombreux organes, système nerveux central en premier (cerveau) mais aussi os, cœur, reins... pourvus de récepteurs spécifiques. C'est aussi dans ce sens que l'on peut parler d'une sexualisation de l'individu.
Caractères sexuels secondaires mis en
place grâce à l'action de la testostérone,
de l'œstradiol (ou estradiol) du DHT chez l'homme, des
œstrogènes (œestradiol principalement) et de
la progestérone chez la femme (mais il faut
aussi compter sur les hormones hypophysaires que nous
étudierons dans le chapitre suivant):
| homme | femme |
| taille des organes génitaux externes (scrotum et testicules + pénis...// lèvres + clitoris) | |
| développement de la pilosité (génitale et pubienne, pectorale, aisselles...) | |
| mue de la voix (développement du larynx) | développement des seins et augmentation des réserves graisseuses des fesses |
| croissance musculaire | élargissement du bassin |
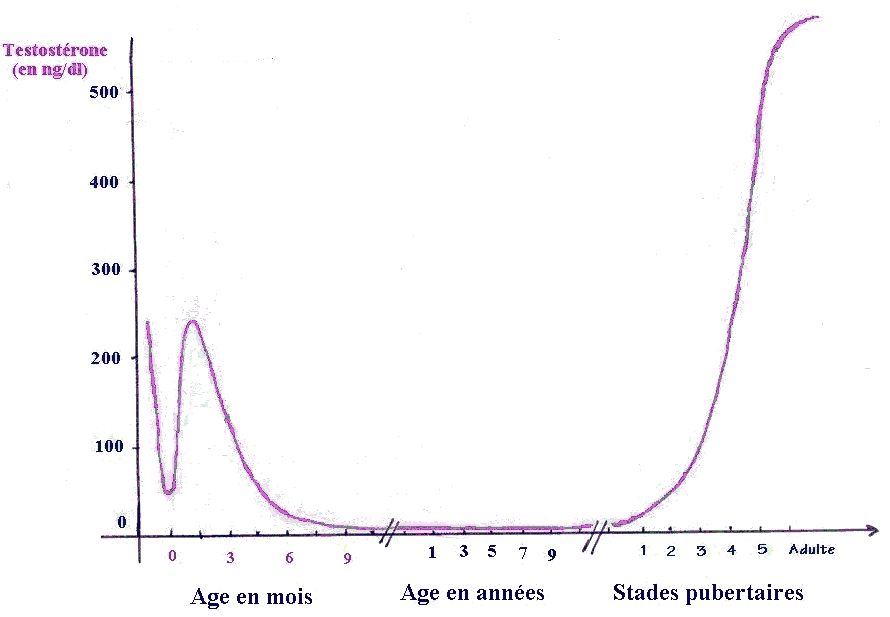
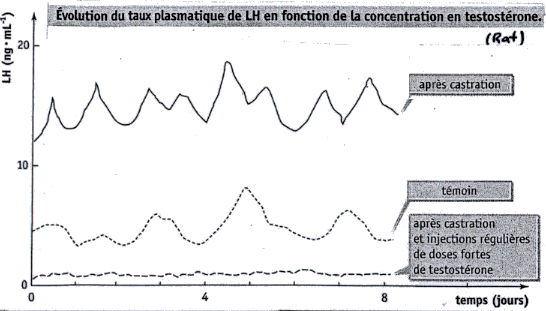
Evolution du taux de testostérone après la naissance jusqu'à la puberté chez un enfant masculin. La testostérone est aussi l'hormone de la mise en place de la fonction sexuelle (spermatogénèse).
(d'après http://www.inrp.fr/Acces/biotic//procreat/determin/images/PeniTesto.jpg)
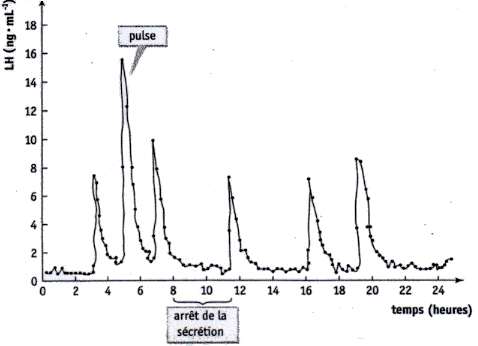
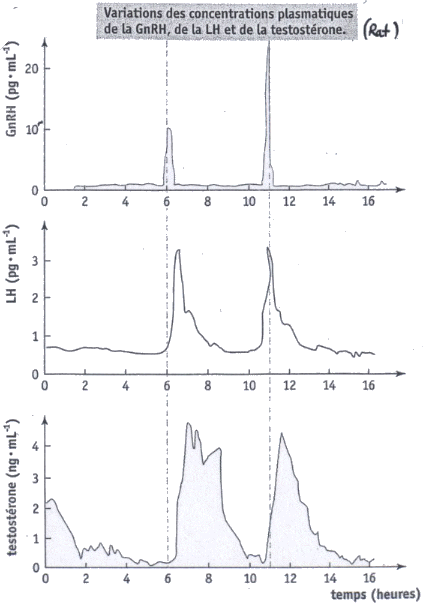
La courbe ci-dessous que l'on retrouve dans de nombreux sujets de bac ES-L permet de mettre en évidence que la puberté commence avec l'inhibition de la sécrétion d'AMH (sécrétée par le sellules de Sertoli), sous le contrôle des cellules de la lignée germinale en cours de développement. Avant le démarrage de la puberté les spermatogonies n'empêchent pas la sécrétion d'AMH par les cellules de Sertoli.
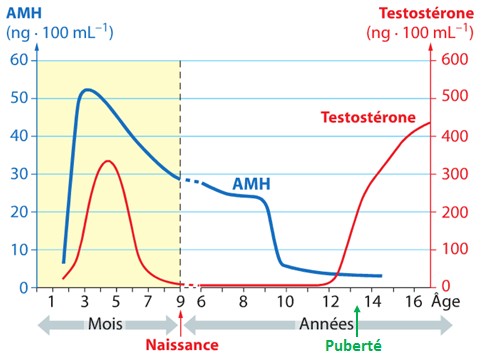
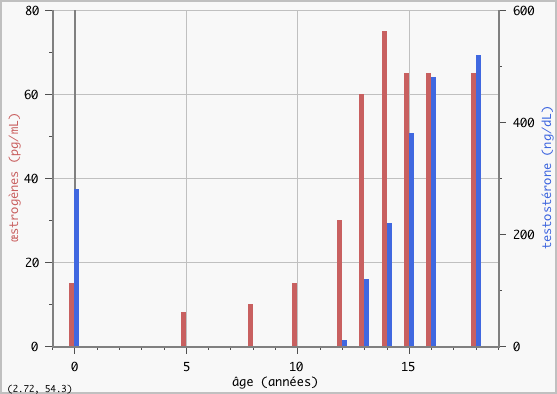
Evolution du taux d'œstrogènes
et de testostérone
chez l'enfant
(![]() avec échelles relatives : la testostérone est en
bien plus grande concentration dans le sang que les
œstrogènes...; les concentrations chez le
fœtus sont très élevées mais non
représentées)
avec échelles relatives : la testostérone est en
bien plus grande concentration dans le sang que les
œstrogènes...; les concentrations chez le
fœtus sont très élevées mais non
représentées)
(d'après les données de la page
http://www.inrp.fr/Acces/biotic// procreat/determin/html/
puberHorm.htm)
Si les mâles présentent bien un pic précoce de testostérone au cours de leur vie fœtale (350 ng.mL-1 centré sur le 15e semaine), leurs masculinisation, notamment des tissus nerveux, est essentiellement due aux œstrogènes. En effet, la testostérone est convertie en œestrogènes (par une enzyme de type aromatase) au sein des neurones affectés qui présentent donc un pic d'œstradiol. Il existe cependant des cas où la testostérone agit sur des cellules munies de récepteurs sépcifiques. Il est possible que les expériences menées chez les primates, qui montrent un rôle essentiel des androgènes, nous aient conduits à accorder trop d'importance à la testostérone pour l'homme.
L'alpha-fœtoprotéine est une protéine que l'on trouve dans le sang des fœtus de mamifères et qui lie les œstrogènes circulants. La testostérone serait donc un moyen pour passer la barrière de l'alpha-fœtoprotéine chez les fœtus mâles.
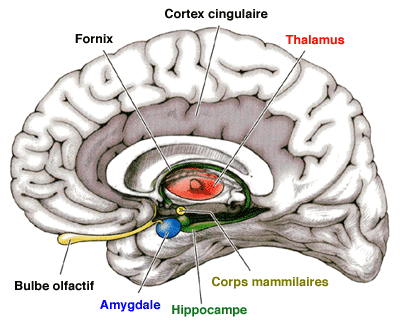
Chez le rat les neurones sensibles à
l'œstradiol sont principalement situés dans des
zones impliquées dans les fonctions reproductrices et
parentales ou qui présentent un dimorphisme sexuel (aire
péoptique, hypothalamus, amygdale...). (voir ci-contre)
Chez l'homme adulte les récepteurs aux androgènes
comme aux œstrogènes sont répartis de
façon beaucoup plus vaste et la sensibilité aux
hormones sexuelles dure toute la vie.
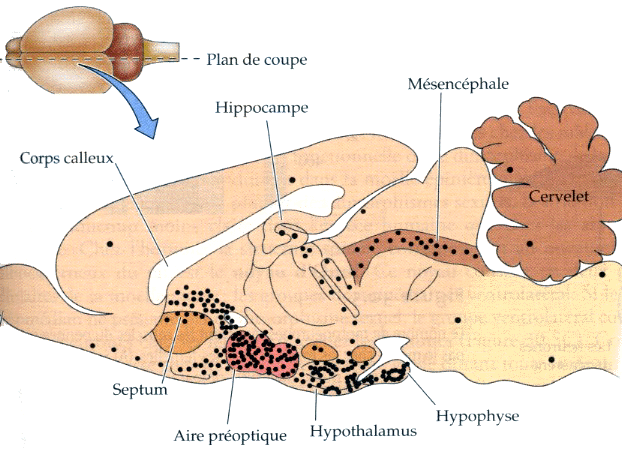
Localisation des récepteurs aux œstrogènes
(points noirs) dans le cerveau de rat
(image provisoire d'après fig 30-4 de Neurosciences)
03/2012 - Une expérience
récente d'une équipe française d'induction
des caractères sexuels secondaires par autogreffe de
tissu ovarien sain faisant suite à un traitement
stérilisant. (article
sur le site de Généthique )
)
Les hommes (XY) atteints du syndrome de l'insensibilité aux androgènes (ne synthétisent pas ou pas suffisamment de récepteurs aux androgènes) développent un type féminin vis-à-vis des caractères sexuels secondaires, leurs gonades sont des testicules stériles (qui ne descendent pas, de toute façon le scrotum est absent) et ils n'ont ni canaux de Müller (et donc ni oviducte, ni utérus, ni vagin) qui ont dégénéré sous l'action de l'AMH, ni épididyme, canaux déférents et vésicules séminales, du fait de leur insensibilité à la testostérone. Les hormones maternelles et placentaires permettent le développement de caractères sexuels secondaires féminins malgré leur production de testostérone.
Des individus déficients en DHT (retrouvés notamment dans une famille en République dominicaine) ont des testicules fonctionnels, une poche vaginale en cul-de-sac et un clitoris hypertrophié. À la puberté les testicules secrètent davantage de testostérone, le pénis grandit et les testicules descendant dans le scrotum et les "jeunes filles" se révèlent être des "garçons".
En résumé, quelques points qui me paraissent importants et insuffisamment développés habituellement :
- L'embryon (zygote fécondé) donne un amas de cellules (morula) qui va donner l'embryon proprement dit (s.s.) et un ensemble de cellules, beaucoup plus nombreuses que les cellules embryonnaires au début, qui donne la partie extraembryonnaire de l'embryon (s.l.). À partir du stade fœtal l'embryon-fœtus grandit beaucoup plus que les tissus extraembryonnaires-extrafœtaux qui participent au placenta et forment la seule poche des eaux (chorio-amnios). Les cellules germinales primordiales viennent de ces cellules extra-embryonnaires.
- Les appareils génitaux sont embryologiquement très liés aux appareils excréteurs : on parle d'appareil uro-génital. Les gamètes produits par les gonades doivent être rejetés à l'extérieur de l'organisme par des conduits dérivés de conduits embryonnaires excréteurs.
- Il n'y a pas qu'au stade de gonade indifférenciée que les deux sexes sont très similaires: les cellules gonadiques sont similaires par leur origine embryonnaire et leurs hormones: cellules de Leydig / cellules thécales : testostérone ; cellules de Sertoli / cellules folliculaires : AMH mais aussi DHT et œstradiol / œstrogènes (notamment par transformation de la testostérone); cellules germinales : cellules sexuelles : spermatides et spermatozoïdes / ovocytes.
- il ne faut pas oublier le rôle des hormones placentaires et maternelles qui sont toujours des œstrogènes quel que soit le sexe du fœtus. (La progestérone, hormone ovarienne et placentaire qui maintient la gestation, sera vue dans le second chapitre)
CONCLUSION
Le sexe est une caractéristique simple : on naît homme ou femme.
Le développement des gonades (sexe gonadique), puis des voies génitales (sexe anatomique) mais aussi le caryotype (sexe chromosomique) peuvent cependant réserver des surprises étant donné le nombre d'anomalies détectées (typiquement 1/1000 ?). Mais la nature d'un phénomène ne se définit pas à l'aune de ses dysfonctionnements, même si ceux-ci sont très utiles pour explorer ses mécanismes.
Comme il s'agit d'un phénomène global vital, une des grandes fonctions du vivant, qui se réfère davantage à l'espèce qu'à l'individu (seule l'espèce doit obligatoirement se reproduire), il faut donc essayer de comprendre les fonctions des cellules et des organes comme faisant partie d'une fonction stable (en homéostase) qui permet, en absence d'anomalie, de mettre en place des gonades qui hébergent et multiplient les cellules sexuelles et sécrètent les hormones sexuelles, des voies génitales qui permettent la copulation, la gestation, et des glandes annexes qui assurent, par exemple, la lactation.
Comme il s'agit ici de l'homme, l'aspect psychologique et l'aspect spirituel au sein d'une anthropologie ne sont pas à négliger.
Du point de vue des neurosciences on en est encore aux balbutiements de notre compréhension de la manière dont le sexe imprègne tous les processus physiologiques, sensoriels, cognitifs... mais dans ce cas on parle de bien autre chose que de reproduction de l'espèce. Le sexe englobe sans aucun doute la personne qui est sexuée. On en revient au mot sexualité, forgé au XIXème, qui est souvent utilisé dans des sens très différents.
Il ne faut pas oublier que le fait d'être de sexe
féminin reste dans le monde actuel le premier
critère de discrimination et même
d'élimination (avortement sélectif; révélé
par exemple en février 2012 en Grande Bretagne; sans parler de l'eugénisme de masse (fœtus
féminins en Chine)
jusqu'aux trisomiques en France
sans parler de l'eugénisme de masse (fœtus
féminins en Chine)
jusqu'aux trisomiques en France ).
).
Au sein d'un réseau génétique encore incertain pour une grande part, on a distingué historiquement un gène majeur situé sur le chromosome X, le gène SRY, très voisin du gène sry exploré chez la souris et qui contrôle la synthèse d'un peptide, le TDF, qui intervient dans la différenciation de la gonade mâle.
- les cellules de la lignée germinale, qui dérivent des cellules germinales primordiales extraembryonnaires (feuillet interne de l'embryon ou endoderme) et donnent toutes les cellules sexuelles qui donneront les spermatozoïdes et les ovocytes;
- les cellules du mésenchyme qui donnent les cellules sécrétrices de testostérone : cellules de Leydig pour le testicule et cellule de la thèque interne pour l'ovaire .
- les cellules de l'épithélium mésodermique qui donnent les cellules sécrétrices d'œstrogènes par la transformation de la testostérone : les cellules de Sertoli dans le testicule et les cellules folliculaires dans l'ovaire.
On n'oubliera pas le fœtus baigne aussi dans les œstrogènes meternels, sans compter quelques sécrétions d'œstrogènes par des cellules fœtales non gonadiques.
La mise en place des voies génitales est dominée par l'action de l'AMH - sécrétée par les cellules de Sertoli - qui induit la dégénérescence des canaux de Müller chez le fœtus masculin, alors que son absence chez le fœtus féminin conduit au développement des canaux de Müller en oviducte, utérus et vagin, sous l'action des œstrogènes fœtaux et maternels. Chez le fœtus masculin, la testostérone contrôle, avec les œstrogènes, la transformation des canaux de Wolff en spermiductes, et la DHT, issue de la transformation de la testostérone par les cellules de Sertoli, contrôle l'apparition des organes génitaux externes (scrotum, pénis...).