le travail du développement...
ou
comment les cellules construisent l'organisme animal
pluricellulaire
d'après le livre "Comment les cellules construisent
l'animal" de Rosine Chandebois,
Phénix-éditions, 1999 (cité avec la
référence RC dans cette page, voir
biblio)
retour cours de seconde,
accueil
(autres ouvrages du même auteur,
voir
biblio)
Les livres scolaires sont cités par le nom de
l'éditeur, la classe et l'année
Autres sources: Biologie moléculaire de la
cellule, Alberts et al., 1994,
Flammarion-Médecine-Sciences: chapitre 21:
Mécanismes cellulaires du développement
Les inductions embryonnaires, Présentation des
données récentes chez le Xénope et les autres
amphibiens, Jean-Claude BOUCAUT et Mariel UMBHAUER,
Biologie-Géologie (Bulletin de l'APBG), n°1, 1994, pp
139-160
De l'œuf à l'embryon, Christiane
Nüsslein-Volhard, Pour la Science, Dossier "Les
sociétés cellulaires", Hors Série, avril
1998, p 44-49
La différenciation cellulaire, Jean-Jacques Kupiec et
Pierre Sonigo, Pour la Science, Dossier "Les
sociétés cellulaires", Hors Série, avril
1998, p 50-53
A l'origine des grands animaux, un petit ver tout nu; ce que nous
disent les gènes de l'embryon sur l'origine des formes
animales, Eric H. Davidson, Kevin J. Peterson et R. Andrew
Cameron, La Recherche, 296, mars 1997, pp 42-48
De la mouche à l'homme, un même supergène pour
l'œil, W. J. Gehring, La Recherche, octobre 1995, 280, pp
58-64
Les gènes à homéobox et l'organisation du
corps, Eddy De Robertis, Guillermo Oliver et Christopher Wright,
Pour La Science, 155, septembre 1990, 50-56
L'origine des doigts, Denis Duboule et Paolo Sordino, La
Recherche, 296, mars 1997, p 66-69
Comment se construisent les doigts ? Yann
Hérault et Denis Duboule, La Recherche, 305, janvier 1998,
40-44
Biologie du développement, Albert Le Moigne, Masson,
1989
Encyclopedia Universalis, version 5 sur CDRom, articles
DEVELOPPEMENT, ONTOGENESE et INSECTES... et tant d'autres
La génétique du développement de la
mouche, Pierre Spierer et Michel Goldschmidt-Clermont, La
Recherche, 165, avril 1985, p 452-461: pour revenir aux sources
et retrouver les postulats et les techniques mises en jeu (programme
génétique, mutations homéotiques, gènes
sélecteurs, marche sur le chromosome ....), décrites
dans un langage simple.
Biologie du développement, Scott F. Gilbert, De
Boeck Université, 1996; une référence, sans
aucun doute; l'auteur reste remarquablement lucide face à la
génétique du développement, même s'il
reste très classique. Une citation pour preuve: (p 74)
«Après bientôt un siècle, nous
commençons à comprendre comment les cellules
contrôlent l'expression différentielle de leurs
gènes de manière à ce que des gènes
différents deviennent actifs dans des cellules
différentes. (...) Un mot de mise en garde cependant. Si le
ton de triomphe de ce chapitre vous donne l'impression que le
développement ne résulte que de l'activité des
gènes ... (...). Dans tous les cas, l'organisme hérite
de l'aptitude à répondre aux signaux de
l'environnement, mais il n'y a pas de prédiction du
phénotype par le génotype.»
Analyse génétique moderne,
Griffiths, Gelbart, Miller et Lewontin, 2001, De Boeck
Université, ch 16, pp 504-530; une présentation
originale d'idées conformes aux théories
habituelles.
Emmanuel Farge: «Certains gènes embryonnaires sont
mécano-sensibles», brève de La
Recherche, 369, novembre 2003, p 16-17 d'après E. Farge,
Current Biology, 13, 1365, 2003
Site internet très documentés
iconographiquement et avec de nombreux liens sur d'autres sites (mais
chiches en données expérimentales): http://www.snv.jussieu.fr/vie/
La page sur le développement embryonnaire de l'hermelle:
http://www.snv.jussieu.fr/bmedia/SiteSabellaria/Sabelbm.htm
est intéressante (la fécondation expérimentale
chez l'hermelle est facile à réaliser dans nos salles
de cours: voir reproduction).
J'attire votre attention sur le passage où l'auteur affirme
qu' "il a été démontré chez d'autres
espèces que Sabellaria, que le lobe polaire correspond
à une région cytoplasmique liée au destin du
blastomère D et qui contient des déterminants
cytoplasmiques nécessaires au rythme du clivage, à la
spécification de l'axe dorsoventral et à la
différenciation du mésoderme. Ces déterminants
seraient liés au cytosquelette cortical. "
Les pages sur le développement embryonnaire du Xénope
sont aussi très riches iconographiquement: http://www.snv.jussieu.fr/bmedia/xenope1/index.htm
et peuvent documenter des recherches faites par les
élèves.
Les pages (texte simple) présentant les
homéogènes ou plutôt les gènes
sélecteurs est illustrée d'images issues de
différentes pages sur internet : http://www.snv.jussieu.fr/bmedia/homeotique/homeo0.html:
une erreur qui me choque: sur la page http://www.snv.jussieu.fr/bmedia/homeotique/
homeo1.html: le code
génétique n'est pas la séquence des bases de
l'ADN du chromosome - qui pourrait plutôt être
qualifiée d'information génétique - , mais la
correspondance ARNm-ARNt-aa )
Le site de l'inrp possède aussi un dossier
sur le développement: www.inrp.fr/Acces/biotic/develop/controle/accueil.htm
, assez hétérogène (type de documents, auteurs,
niveau des sources... très variables). La page
pédagogique http://www.inrp.fr/Acces/biotic/develop/controle/html/plan.htm
appelle bien des réserves et je souhaite y substituer une
toute autre démarche (voir
cours de seconde).
Plan de cette page:
- 1. Les grands axes de
symétrie de l'embryon sont définis
précocement
- 2. le comportement
cellulaire
- 2.1 le comportement cellulaire est l'expression du
travail du vivant
- 2.2 le début du développement (segmentation)
semble fondamentalement reposer sur
l'autonomie cellulaire,
reflet du travail de reproduction mais sous l'étroite
dépendance de la mémoire ovocytaire
- 2.3 le système population cellulaire est
à la base de l'organogenèse et semble
dominé par le comportement
social des cellules, reflet du travail de relation
- 2.3.1 le système population et la progression
autonome
- 2.3.2 le système population et la
genèse de la forme des organes
- 3. l'individu
intègre les populations en systèmes
coordonnés
suite de l'exemple de la drosophile - le développement
postembryonnaire - le système individu dans la
théorie de Mme Chandebois
- les techniques de la
génétique du développement
- Annexe: l'apoptose, un processus
habituel du développement
Depuis les travaux de Archibald Garrod, Georges Wells Beadle,
Edward Tatum, pour n'en citer que quelques-uns (voir une histoire
de la génétique), la notion de programme
génétique c'est progressivement imposée pour
désigner les mécanismes à l'origine du
développement d'un organisme. Ce n'est pas sans
réticences que ce mot a été accepté par
les embryologistes qui travaillaient sur un embryon qu'ils
considéraient comme engagé dans un développement
autonome. Les généticiens du développement se
sont lancés dans la recherche des mécanismes qui
mettent en action ce programme, avec la certitude qu'il y avait bien
un programme, et ont obtenu des résultats extrêmement
riches, grâce à des techniques de plus en plus
sophistiquées. Plus les résultats s'accumulent, tous
interprétés dans le cadre de cette théorie, plus
la notion de programme génétique devient
évidente et "acceptée" par tous les scientifiques. On
pourrait même dire qu'actuellement TOUTES (?) les
découvertes scientifiques, même en embryologie (?), sont
INTERPRÉTÉES dans le cadre de cette théorie, du
fait du l'aspect social, politique des sciences, l'argent de la
recherche étant distribué prioritairement (si ce n'est
exclusivement) à ceux qui travaillent dans cette
théorie et avec ces modèles (Drosophila
melanogaster, axolotl, Cænorhabditis elegans,
Arabidopsis...). Qui suis-je pour essayer de remettre en cause
ce postulat ? Et pourtant je crois qu'il est nécessaire de
reformuler toutes les questions, puisqu'on demande aux enseignants du
secondaire d'enseigner le développement. Et ainsi mettre en
avant la part de la théorie dans tout résultat
expérimental. Suggérer une autre théorie que le
paradigme dominant n'est peut-être pas le rôle d'un
enseignant du secondaire. Cependant, un site internet pourrait
être un bon outil pour élargir la discussion avec un
assez grand nombre de collègues. Cette page est le reflet de
mon travail et une ouverture, je n'ai aucune prétention
à présenter une vérité enseignée,
même si j'utiliserai cette page pour construire mon cours.
La position de l'enseignant, et encore plus
dans le secondaire, n'est pas propice à la participation
à des discussions théoriques avec les chercheurs, on a
souvent l'impression d'avoir quitté le lieu où se
construit la science en passant du laboratoire à la classe.
Mais il nous reste une passion pour essayer de comprendre, par
bribes, tous les articles de "vulgarisation de haut niveau" (La
Recherche, Pour la Science) qui nous tombent sous la main... et des
ouvrages que nous achetons régulièrement pour nous
"maintenir au courant" (collection DeBoeck Université pour
n'en citer qu'une). Oserais-je dire que la théorie actuelle de
la génétique du développement, ne me satisfait
pas (je n'arrive pas à l'enseigner car je ne suis pas
convaincu), tout comme la manière d'aborder la
génétique et tant d'autres questions comme
l'immunologie ou la physiologie dans les programmes du secondaire?
Pour cette partie je vais donc essayer encore une fois de faire un
cours qui, s'il n'est pas politiquement correct, reste, je
l'espère, scientifiquement correct. Mes erreurs viennent de
mes ignorances (reconnues ou non) et je sais bien que je ne suis ni
un embryologiste, ni un généticien... de laboratoire.
Mais je revendique le droit à comprendre avant d'enseigner. Je
vais faire souvent référence à la théorie
de Rosine Chandebois, qui me paraît un très bon fil
directeur, même si je ne la comprends certainement pas dans son
intégralité, et si je l'adapte certainement à ma
manière de voir, en essayant, à chaque fois de remonter
aux expériences, ce qui n'est pas toujours facile. J'ajoute
que se réclamer d'une certaine philosophie ou idéologie
de façon claire et ouverte (ici, un vitalisme) n'est jamais
aller contre la science, c'est l'idéologie masquée qui
est mensonge.
retour plan
1. Les grands axes de symétrie
de l'embryon sont définis précocement
Par exemple chez les amphibiens on pense que les axes de
symétrie de l'embryon sont définis par la charge en
vitellus (axe animal-végétatif) et par le point
d'entrée du spermatozoïde (axe dorso-ventral). C'est donc
dans l'ovogénèse que l'on serait tenter d'abord de
rechercher des éléments directeurs du
développement.
1.1 l'ovogénèse
Les ovogonies sont issues de mitoses (dites goniales) qui
:
- cessent au dernier stade larvaire avant la mue nymphale chez les
insectes;
- présentent une activité saisonnière chez les
amphibiens et quelques poissons osseux: après chaque ponte un
stock d'ovocytes est reconstitué à partir d'ovogonies
quiescentes;
- cessent, à de rares exceptions près, chez les
reptiles, les oiseaux et les mammifères, à la fin de la
vie embryonnaire ou peu après l'éclosion ou la
naissance.
Les ovogonies évoluent en ovocyte dès la fin
de la mitose en augmentant leur volume et la méiose se bloque
à la fin de la prophase de première division (stade
diplotène): on parle d'ovocytes I. C'est ici que
commence le véritable développement embryonnaire (Le
Moigne, p 25) avec des synthèses d'ARN, de protéines
nécessaires au développement de l'embryon, et avec
l'accumulation de réserves.
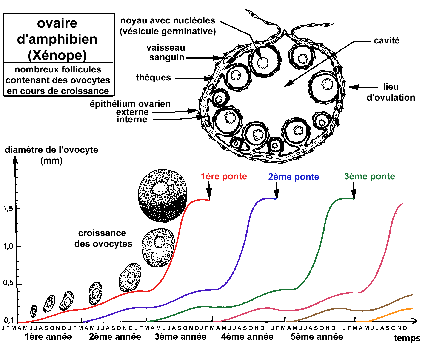
Croissance des follicules ovariens et des ovocytes chez le
Xénope (d'après Le Moigne, p
30-31)
Les nids d'ovogonies de l'ovaire ne sont pas
représentés (nombreuses mitoses goniales après
chaque ponte pour reconstituer le stock d'ovocytes en croissance).
Trois générations d'ovocytes en croissance sont
présentes simultanément dans chaque ovaire.
La maturation d'ovocyte I à ovocyte II commence par
migration de la vésicule germinative au pôle animal
(déterminant une tache claire de maturation). Celle-ci se
rompt et expulse le premier globule polaire (GP1). Les chromosomes se
bloquent au stade métaphase de la 2ème division de
méiose. De nouvelles protéines (dites de maturation)
apparaissent et passent du nucléoplasme au cytoplasme et
inversement. Elles persistent pendant la segmentation. Leur
synthèse est nécessaire à l'expulsion du GP1
(l'inhibition de leur synthèse empêche cette expulsion).
Les ARN nucléaires migreraient dans le cytoplasme et leur
localisation serait déterminante pour la symétrie
dorso-ventrale de l'embryon. Les cellules folliculeuses
(épithélium ovarien interne), dont les prolongements
étaient étroitement associés avec le cytoplasme
périphérique de l'ovocyte (formant une zona
radiata), se rétractent et se détachent de
l'ovocyte.
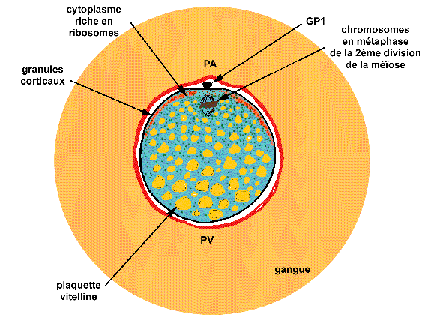
Ovocyte II de grenouille ovulé
(d'après Le Moigne, p 81)
Le diamètre de l'ovocyte (avec sa gangue) atteint
souvent 5 mm (2mm sans sa gangue). La membrane vitelline (en rouge)
enferme le globule polaire 1 (GP1) expulsé quelques heures
avant l'ovulation et l'ovocyte II dont les chromosomes sont
bloqués en métaphase de 2ème division de
méiose. Les granules corticaux colorant le cytoplasme
périphérique se trouvent à la
périphérie du cytoplasme et dans la moitié
apicale (absents chez les Urodèles et au voisinage du
pôle animal formant ainsi une tache de maturation, plus
claire). Le cytoplasme interne présente une
polarité: le hyaloplasme est présent en
majorité au pôle animal (PA) où se concentrent
les ribosomes (en vert) et est peu abondant au pôle
végétatif (PV) où dominent les réserves,
notamment, le vitellus (en jaune). Les polarités sont
associées à des structures dynamiques ou statiques du
cytosquelette.
|
Le vitellus est concentré au pôle
végétatif dans des plaquettes vitellines de
grande taille. Le terme ancien de "vitellus" désigne
un ensemble de substances sécrétées en
dehors de l'ovocyte, transportées par le sang et
accumulées dans le cytoplasme de l'ovocyte
(protéines et phosphoprotéines
synthétisées par le foie et accumulées
sous forme de plaquettes associant des protéines et
des lipides (phosvitine et lipovitelline
dérivant toutes deux de la
vitellogénine) sous contrôle
mitochondrial, du glycogène et des lipides).
|
|
(en masse)
|
eau
|
protéines
|
lipides
|
glucides
|
divers
dont acides nucléiques
|
diamètre
|
|
ovocyte II
|
52,5%
|
34,5%
|
7,5%
|
3%
|
2%
|
2 mm
|
|
cellule typique d'amphibien
|
70%
|
18%
|
5%
|
2%
|
5%
|
50 à 100µm *
|
|
* le diamètre normal d'une cellule eucaryote est
d'environ 20 à 40 fois plus faible que celui de
l'ovocyte; on considère ainsi que l'accroissement de
volume est de 27000 fois entre l'ovogonie et l'ovocyte II;
ne pas oublier que l'accroissement de volume, pour une
sphère, est proportionnel au cube de celui du
rayon...
|
Le stock d'ARN maternels de l'ovocyte se constitue à
partir d'une synthèse phénoménale: 89 % (pendant
la prévitellogénèse) à 95% (pendant la
vitellogénèse) des ARN synthétisés dans
le noyau sont dégradés avant de passer dans le
cytoplasme (la durée de vie des ARNm est courte: une demi-vie
de 35 jours est considérée comme fort longue et
caractérise des ARN stables). Le stock d'ARNm stables de
l'ovocyte est maintenu grâce à des transcriptions
incessantes (on estime à 15.000 le nombre de protéines
traduites à partir de ces ARNm maternels). Les ARNm
dirigés vers le cytoplasme sont utilisés pendant la
segmentation car aucun gène maternel n'est actif pendant cette
période et la traduction des ARN paternels ne commence
qu'à la mi-blastula pour les amphibiens et la drosophile
(dès la fécondation chez les oursins et les
mammifères). En tout cas on peut dire que le
développement du jeune embryon ne dépend pas
immédiatement des premières synthèses d'ARN de
son génome original. Ce décalage dans le
temps de l'expression de l'information génétique
propre de l'embryon est un argument fort pour rejeter
l'idée d'un programme génétique embryonnaire de
développement.
De nombreux ARNr sont aussi synthétisés. On estime
à 1012 le nombre de ribosomes contenus dans un
ovocyte de Xénope, ce qui est 100 fois supérieur
à celui des ribosomes produits en une année par une
cellule banale de l'organisme adulte. Cette synthèse de
ribosomes est réalisée grâce à la
réplication (500 à 2000 copies) de l'organisateur
nucléolaire (environ 500 gènes identiques codant pour
les ARN40s, précurseurs des ARNr18s et 28s) à l'origine
de nucléoles surnuméraires. La masse d'ADN
supplémentaire serait de l'ordre de 30 pg sur les 40 pg
correspondant à la masse d'ADN totale du noyau de
Xénope.
Ces données, certainement un peu
anciennes, pourraient être revisitées à l'aide
des nouvelles théories de M. Beljanski sur le rôle des
ARN (voir page
de génétique).
Peut-être tous ces ARN ne sont-ils pas des ARNm ou des ARNr
mais y-a-t-il parmi eux nombre d'ARN transformants, contenant une
réelle information héréditaire pouvant
être transcrite de façon inverse dans l'ADN (par une
transcriptase inverse que M. Beljanski a isolé dans des
œufs de poissons notamment) où être
stabilisée (comme épisome et ainsi transmise par
exemple à une lignée cellulaire) ou encore
utilisée.
Les protéines spécifiques
synthétisées lors de la maturation de l'ovocyte sont
par exemple des histones (en quantité suffisante pour 20.000
cellules), de la nucléoplasmine (intervenant dans l'assemblage
des histones avec l'ADN), de la tubuline, des protéines
ribosomiques, de l'ADN polymérase, de l'ARN polymérase
( une vésicule germinative à une activité
ARNpolymérasique égale à celle de la
totalité des ARN polymérase de 400.000 cellules), de la
fibronectine...
Remarques:
- L'ovocyte de mammifères présente beaucoup moins
de synthèses que l'ovocyte d'amphibien même si l'on
observe quelques nucléoles supplémentaires et une
synthèse accrue d'ARNr. Il n'y a pas de véritables
chromosomes en écouvillons même si des
déspiralisations sont possibles. La teneur de l'ovocyte en
protéines augmente environ d'un facteur 100 lors de sa
croissance jusqu'au stade ovocyte I ; notamment des histones, qui
représentent un stock pour 10 cellules, de l'actine, de la
tubuline...
Chez les insectes comme la Drosophile, les cellules germinales
gardent entre elles des ponts cytoplasmiques et assurent
l'approvisionnement en ARN de l'unique cellule qui évolue
en ovocyte I. C'est un moyen original d'augmenter les
synthèses sans passer par la duplication du matériel
génétique d'une seule cellule.
- On pourrait penser que la complexité des ARN
utilisés pour la synthèse des protéines
augmente avec la complexité biologique de l'embryon, mais
il n'en est rien. Les expériences de Galau montrent que,
même chez les oursins, la complexité totale des ARN
des polysomes diminue légèrement pendant le
développement. La plus grande part de l'activité de
transcription de l'embryon est consacrée à remplacer
les ARNm homologues de l'ovocyte (à partir des gènes
maternels ou paternels). Les ARNm tardifs ne constituent qu'une
faible minorité du message total contribuant à la
différenciation des organes et des tissus.
1.2 fécondation
La fécondation est externe chez les amphibiens et en
milieu aquatique, essentiellement représenté par la
gangue muqueuse qui entoure les œufs: le mâle arrose de
son sperme les ovocytes II pondus par la femelle (le mâle tient
fermement le dos de la femelle: c'est l'amplexus). La
pénétration du spermatozoïde, provoquant une
traînée spermatique, formée par les pigments
corticaux entraînés avec le noyau spermatique, n'est
possible que dans le seul hémisphère animal. Elle
déclenche des remaniements qui déterminent le plan de
symétrie dorso-ventral de l'embryon dans les deux heures qui
suivent la fécondation. Le second globule polaire est
émis, les granules corticaux rejettent leur contenu à
l'extérieur du zygote (réaction corticale) et la
membrane vitelline devient membrane de fécondation, se
décolle de la membrane plasmique ce qui permet dans les 30 min
suivant la fécondation (à 18°C), une rotation
du zygote sous l'effet de la pesanteur, le pôle
végétatif, plus lourd, s'orientant vers le bas (on
parle de rotation d'équilibration). Chez les
Urodèles il peut y avoir pénétration de
plusieurs spermatozoïdes.
Une heure 10 min après la fécondation (toujours
à 18°C) le cytoplasme superficiel (pigmenté)
réalise une rotation de symétrisation qui est un
mouvement de bascule autour d'un axe passant par le centre de
l'œuf et orthogonal à un plan déterminé par
les pôles animal et végétatif et la
traînée spermatique (qui devient le plan de
symétrie dorso-ventral de l'embryon). Le cytoplasme
pigmenté se recentre en quelque sorte d'environ 30°
autour du point d'entrée du spermatozoïde. Le cytoplasme
peu pigmenté découvert par ce mouvement
détermine un croissant plus claire appelé croissant
gris. Il détermine la région dorsale du futur embryon.
Chez le Xénope le mouvement de rotation de
symétrisation est dirigé par les microtubules qui se
développent en aster (spermaster) autour du centriole qui a
pénétré dans l'ovocyte avec le noyau du
spermatozoïde. Le détail des mouvements sort du cadre de
ce petit aperçu mais il faut aussi tenir compte des mouvements
du noyau de l'ovocyte II fécondé (pronucléus
femelle) et de la présence de nombreux microtubules
localisés essentiellement dans le cytoplasme cortical du
zygote. Chez les Urodèles le déterminisme de la
symétrisation de l'embryon est inconnue.
|
En résumé :
Un zygote d'amphibien n'est pas uniquement un noyau
contenant une information génétique et un
cytoplasme contenant une machinerie.
- C'est une cellule TOTIPOTENTE, c'est-à-dire
capable d'une intense multiplication (développement
AUTONOME), et pouvant donner tous les types cellulaires d'un
individu.
- C'est une cellule polarisée et même
ORIENTÉE: si elle est globalement
sphérique son contenu n'est pas réparti de
façon homogène: plaquettes vitellines
(concentrées plus au pôle
végétatif qu'au pôle animal) et
ribonucléoprotéines (selon le gradient
inverse: les ribosomes et les ARN sont plutôt
concentrés au pôle animal); son cortex contient
des granules pigmentant l'hémisphère animal.
Le plan de symétrie bilatéral de l'embryon des
amphibiens Anoures contient les pôles animal et
végétatif et la traînée
spermatique laissée par la pénétration
du spermatozoïde.
- C'est une cellule protégée par une
membrane et des enveloppes extérieures (gangue,
cellules folliculeuses). Sa position n'est pas non plus
indifférente: son environnement doit
être favorable pour que le développement se
poursuive. Dans le cas des amphibiens à
fécondation externe et à développement
aquatique, l'embryon se développe facilement dans sa
gangue muqueuse si la température de l'eau n'est ni
trop élevée ni trop basse.
Il n'est pas rare de voir
écrit que le zygote est une cellule qui contient
toute l'information nécessaire pour faire un individu
pluricellulaire complet adulte. Mais cette vision n'est
pas neutre philosophiquement. On pense facilement à
une information figée et stable qu'il faut
progressivement utiliser. Si cette affirmation est analogue
à celle qui suppose qu'un bébé
possède toutes les capacités
nécessaires pour devenir un homme, cela est sans
doute vrai, mais affirmer qu'il existe un programme, un
déterminisme, en acte, dans le zygote, c'est aller
beaucoup plus loin que de penser qu'il y a une
potentialité, qui pourra s'épanouir, s'il n'y
a pas d'accident, et si l'environnement est favorable
à chaque étape du développement. On
peut emprunter à Bergson sa vision du futur qui n'est
pas, qui n'est pas même un possible car il serait
alors déterminé. C'est la vie qui
est le seul lieu de l'être, c'est le
présent qui est mais ni le passé ni le futur.
Le maintien dans l'être, le développement dans
l'être est un présent nouveau posé
à chaque instant du vivant. Cette question est bien
sûr essentielle quand il s'agit de s'entendre sur le
début de la vie de la personne pour l'être
humain.
|
1.3 Expériences sur
les ovocytes
|
1 - Expériences dites "de Gurdon",
1973: transplantation nucléaire chez la
grenouille (J.B. Gurdon, Gene expression
during cell différenciation, Oxford, U.K. : Oxford
University Press, 1973, cité dans Biologie
moléculaire de la cellule, 1994, p 1051; nombreuses
autres données dans Biologie du développement,
1989, p 206-212)
|
|
Un œuf non fécondé mais mature
(ovocyte II) de grenouille est irradié au pôle
animal à l'aide d'U.V. (voir lumière,
bien que je n'ai pas réussi à trouver
précisément ce que l'on détruisait par
les U.V...) qui dégradent la vésicule
germinative (voir ci-dessus et plus bas). On injecte
alors dans le cytoplasme de l'ovocyte ainsi
énucléé un noyau (2n) d'une cellule
dédifférenciée d'un tissu d'une
grenouille adulte. Il faut aussi noter que seules
certains tissus peuvent être mis en culture et se
dédifférencier, comme par exemple les
kératinocytes: cellules de la peau
synthétisant de la kératine comme
protéine essentielle. L'injection du noyau se solde
souvent par la mort de la cellule
énucléée et transplantée mais
parfois on réussit à obtenir des divisions de
l'ovocyte transplanté. Pour obtenir un
têtard il est nécessaire de réaliser une
seconde transplantation d'un noyau issu d'une cellule de la
blastula (massif embryonnaire à une
cavité) à l'intérieur d'un second
ovocyte énucléé.
|
|
2 - Expériences de Gurdon, 1968 : technique de
transplantation nucléaire chez le Xénope;
(Biologie du développement, A. Le
Moigne, Masson, p 208)
|
|
ovocyte II irradié (UV) au pôle
animal pour détruire la vésicule germinative
(lignée ovocytaire à 2 nucléoles) +
transplantation à la pipette d'un noyau de
cellule d'intestin de têtard (un seul
nucléole). Donne une blastula dont on
prélève les noyaux que l'on retransfère
dans des ovocytes énucléés comme
précédemment; on obtient:
- des blastulas que arrêtent leur développement
au stade bourgeon caudal
- des blastulas dont on prélève une fois
encore les noyaux pour les transplanter dans des ovocytes
énucléés receveurs et qui donnent cette
fois:
* des embryons anormaux
* des têtards anormaux et parfois normaux.
Il est à noter que les transferts doivent être
très nombreux pour espérer obtenir un
développement complet. Les embryons obtenus ont des
cellules à noyaux mononucléolés, preuve
que les noyaux de l'embryon proviennent du noyau
greffé.
|
|
remarques:
- la méthode semble avoir été mise au
point par Briggs et King en 1952
- la piqûre de l'ovocyte II permet aussi dans certains
cas d'obtenir par gynogénèse
(parthénogenèse à partir d'une cellule
sexuelle femelle: voir
cours sur la reproduction) un embryon normal,
après division du noyau à n chromosomes de
l'ovocyte. D'autres signaux mécaniques et chimiques
peuvent aussi lancer le développement
parthénogenétique.
- seuls certains types cellulaires peuvent se
dédifférencier notamment les cellules
épithéliales; les cellules sont
dissociées à l'EDTA-
éthylène diamine tétracetic acid
- seules certaines espèces de grenouille permettent
de réaliser de telles transplantations
- aucune transplantation interspécifique ne conduit
à un développement complet : le cytoplasme
d'un ovocyte d'une espèce ne peut être
transplanté que par un noyau d'une cellule de la
même espèce, même si on a
réalisé des greffes (ovocyte
énucléé de Pleurodèle et noyau
de cellule de rein de Xénope), pour pouvoir
distinguer les protéines ovocytaires et les
protéines issues du génome du donneur... ce
qui a permis de montrer que les protéines
nouvellement synthétisées sont des
protéines ovocytaires de Xénope (et jamais de
protéines rénales) ...
- l'ovocyte II des amphibiens présente un noyau
volumineux à nombreux nucléoles (en plus des 2
présents dès le stade ovocyte I) appelé
vésicule germinative (la croissance de
l'ovocyte des amphibiens dure près de 3
années; voir plus haut); c'est en son sein qu'on
trouve les fameux chromosomes en écouvillon qui ont
permis d'étudier la synthèse des ARN dans
l'ovocyte et notamment la synthèse des ribosomes
à partir des ARNr... le rôle et la
répartition du stock très important d'ARN et
notamment d'ARNr synthétisés lors de la
maturation de l'ovocyte (grâce notamment aux
nucléoles supplémentaires) a été
très étudié pour rendre compte des
premières étapes du développement: les
ARNr de l'ovocyte correspondent à un stock suffisant
jusqu'au stade bourgeon caudal et les ARNt peuvent
approvisionner 60 000 cellules.... Dans "l'expérience
de Gurdon" je ne sais pas ce qui a été
vraiment détruit par les UV même si l'ARN est
plus stable que l'ADN...
- le tableau ci-dessous résume quelques
résultats de transplantations
(Biologie du développement, A. Le
Moigne, Masson, p 207-208)
|
cellule énucléée
receveuse
|
cellule donneuse de
noyau
|
résultats
|
|
cerveau de l'adulte
|
cellules de mi-blastula
|
|
ovocytes I
en cours de maturation
|
|
arrêt des divisions et début de
synthèse d'ARN
|
dans tous les cas le noyau transplanté
modifie son activité pour se conformer aux
activités normales de la cellule
receveuse
augmentation du volume des noyaux des cellules
somatiques transplantés, toujours plus
petits que la vésicule germinative ( 3 fois
pour un noyau d'une cellule de blastula et 60 fois
pour le noyau d'un cellule de cerveau); ce qui
indique qu'il y a passage d'éléments
cytoplasmique dans le nucléoplasme, ce qui a
été démontré
|
|
ovocytes II
|
arrêt des synthèses d'ARN,
condensation des chromosomes sans synthèse
d'ADN
|
|
|
zygote
ou
ovocytes II
activés mécaniquement
|
arrêt de la synthèse d'ARN,
début de synthèse d'ADN et
division
|
|
|
... d'autres expériences ont
été réalisées avec des
cellules différenciées de rein,
cœur, des lymphocytes, des erythrocytes..et
ont permis de d'aller tout au plus jusqu'au stade
de têtard nageant
|
Les biologistes moléculaires interprètent
habituellement cette expérience en terme
d'expression différentielle de l'information
génétique contenue dans le noyau d'une
cellule. C'est ainsi qu'ils parlent aisément de
clonage, en référence à
l'information génétique potentielle contenue
dans les cellules de l'embryon formé (le têtard
possède matériellement la même
information génétique que l'adulte qui a
fourni le noyau transplanté).
Les embryologistes préfèrent parler de
programme ovocytaire induit par le cytoplasme: les
gènes des noyaux quiescents injectés sont
activés par le cytoplasme selon un programme de
synthèse de type ovocytaire (Le
Moigne, p 209). Pour ce qui est des caractères
héréditaires, étant donné le peu
de réussite de la technique (nombre de têtards
viables en regard du nombre de transplantations
effectuées... moins de 1% certainement), on ne voit
pas comment on pourrait l'étudier et quelle serait le
degré de généralité des
conclusions.
|
|
A ces expériences sur les amphibiens il faudrait
ajouter les récents résultats obtenus sur les
mammifères (Dolly...). Un dossier à consulter:
"Clonage: la nature résiste",
La Recherche, 334, septembre 2000, 28-40. «
Depuis l'événement Dolly, en 1996, beaucoup
d'animaux ont été clonés avec
succès. Mais le taux d'échec est
considérable. Beaucoup d'animaux ont des
problèmes (il y a probablement une erreur de fond
dans la recette...). Maint succès annoncé n'a
pu être reproduit...»
|
retour plan
2. le comportement
cellulaire
2.1 le comportement cellulaire est l'expression du travail du
vivant
Des principes du fonctionnement cellulaire à ceux du
développement
(extrait de Comment les cellules construisent
l'animal, Rosine Chandebois, phénix éditions, 1999,
p 24-25)
« Si on a postulé puis justifié l'existence
d'un programme génétique ou de prepatterns qui
orchestreraient les activités des cellules, c'est pour avoir
donné de celles- ci une idée simplifiée à
outrance. Avec un schéma plus élaboré, d'autres
principes s'imposent pour le développement.
La libération différentielle de l'information
génétique, qui est le principe de la
différenciation cellulaire, est encore attribuée
à la seule répression d'une partie du génome,
sans accorder à la variabilité des rendements des
gènes l'importance capitale qui lui a été
reconnue. Celle- ci simplifie pourtant les problèmes dans la
mesure où elle permet d'attribuer le même
déterminisme à la différenciation tissulaire,
apparemment d'ordre qualitatif, et à l'extrême
diversité, dans chaque tissu, des rendements des
synthèses spécifiques, puisque les cellules
présentent les caractères histologiques d'un tissu
donné lorsque leurs " valeurs" se situent dans une certaine
marge.
Par ailleurs, on a pensé que le rôle particulier
joué par chaque cellule lui est entièrement
dicté à chaque instant parce qu'on a ignoré la
mémoire cellulaire. Une activité biochimique
momentanément entretenue par une cellule laisse dans son
cytoplasme des traces qui sont transmises à sa descendance,
mais qui toutefois s'effacent plus ou moins si elle est
isolée. Ainsi, la singularité d'une cellule de
l'organisme a été créée par un effet de
sommation des informations extra-cellulaires successivement
enregistrées par son ascendance depuis le début du
développement, un progrès qui aurait été
rendu impossible sans l'entretien d'une mémoire collective.
En ne voyant dans les cellules que des machineries de
molécules commandées par les gènes, on a omis de
prendre en considération les diverses composantes de leur
comportement d'organismes autrefois libres. Or elles jouent un
rôle essentiel dans la ségrégation des fonctions
tissulaires et dans la création de la forme. Sensibles aux
variations du métabolisme et aux agressions
extérieures, leur dérèglement est à
l'origine des malformations congénitales et accidentelles.
Si, dans l'organisme en développement, la cellule constitue
une unité fonctionnelle et morphogénétique -
parce que douée d'une certaine autonomie dans
l'accomplissement de son métabolisme et dans son comportement
individuel -, elle ne doit pas être considérée
comme une unité opérationnelle, puisque les
gènes, manipulés par le cytoplasme, ne peuvent
être à l'origine de changements quelconques dans leurs
activités. La cellule répond seulement à
des modifications dans son environnement, soit dans les cellules avec
lesquelles elle est en contact direct, soit dans la composition du
milieu intercellulaire. Il s'en suit que la différenciation
des cellules représente le travail de systèmes qui
intègrent leurs activités.
Les principes de leur fonctionnement sont ceux des
systèmes cybernétiques dits "
téléonomiques", qui ont pour particularité de
s'organiser seuls ( autopoïèse). Ce travail n'implique
pas une augmentation des capacités des unités
fonctionnelles, mais leur permet d'utiliser celles qu'elles ne
peuvent manifester isolément. Les unités d'un
système téléonomique doivent être
conçues spécialement pour communiquer, pour entretenir
des activités très diversifiées, pour garder la
mémoire d'activités temporaires (où
définitives quand le système, ayant
épuisé ses capacités, est amorti), soit
individuellement, soit collectivement.
Ce sont précisément là les
caractéristiques des cellules qui ont constitué des
organismes extrêmement complexes, sans augmentation de la masse
d'ADN contenue dans leur noyau. »
|
Une cellule est une unité fonctionnelle et
structurale: son activité ou comportement peut
être regardé selon les trois composantes du
travail du vivant qu'elle réalise, même si
les limites en sont un peu floues: travail de relation, de
nutrition et de reproduction.
* le travail de relation qui, pour un ensemble de
cellules peut être considéré comme le
comportement social: le zygote, puis les cellules
embryonnaires, reçoivent et émettent en
permanence des informations des et vers les cellules
voisines par l'intermédiaire de leur membrane. On
distingue les interactions entre cellules (comme
l'induction...) , la cohésion,
l'adhésion sélective, le
déplacement orienté... A l'information
instantanée reçue par une cellule en
provenance de son environnement, il faut ajouter la
mémoire cellulaire qui englobe l'ensemble des
informations qui se sont accumulées dans son
cytoplasme sous forme de gradients, de métabolismes,
voir de répressions ou d'activations de
gènes...ces informations n'étant ni
permanentes (elles s'effacent plus ou moins vite si l'on
isole les cellules), ni transmises intégralement aux
cellules filles. L'unité fonctionnelle de l'embryon
en développement n'est pas la cellule mais la
population cellulaire.
* le travail de nutrition qui est mesuré
essentiellement par le métabolisme, sous
étroite dépendance de l'information
génétique (ARN et gènes
exprimés) mais aussi de la mémoire
cytoplasmique (voir ci-dessus): les premières
cellules embryonnaires consomment les réserves
accumulées et expriment le matériel
génétique maternel ( stocké sous la
forme d'ARNm maternels) puis progressivement elles mettent
en place un métabolisme plus ou moins
spécifique (expression du génome maternel et
paternel hérités) dont les
caractéristiques déterminent pour une bonne
part l'identité tissulaire d'une cellule, sous le
contrôle de informations extracellulaires arrivant des
cellules voisines. On peut aussi placer au sein de ce
travail les capacités d'auto-destruction -
cytolyse ou autolyse ou encore mort programmée
(apoptose*) -
qui sont très importantes dans le
développement embryonnaire: de nombreux tissus
embryonnaires sont édifiés provisoirement et
sont détruits ensuite au cours du
développement, les cas les plus marquants
étant les organes larvaires des animaux à
métamorphoses.
* le travail de reproduction qui se concrétise
par les capacité de division
(prolifération).
|
2.2 Le début du développement (segmentation) semble
fondamentalement reposer sur l'autonomie
cellulaire, reflet du travail de reproduction mais sous
l'étroite dépendance de la mémoire
ovocytaire
La segmentation est totale et inégale chez les amphibiens;
elle commence 2h30 après la fécondation (à
18°C); elle se déroule, comme le reste du
développement embryonnaire, dans la gangue protectrice. Le
premier plan de segmentation est dans 50% des cas très proche
de celui de la symétrie bilatérale défini
après la fécondation.
Les embryologistes proposent comme hypothèse du
déterminisme des premières divisions la présence
de différents déterminants cytoplasmiques (ou pourrait
parler de mémoire ovocytaire) que l'on a
étudié notamment dans les œufs des ascidies, des
mollusques et des annélides dits "en mosaïque"(chaque
cellule de la blastula a une détermination précise et
on ne peut enlever des fragments cytoplasmiques ou fragmenter la
blastula sans aboutir à un arrêt du
développement; alors que dans les œufs "à
régulation" - comme chez les oursins et les
vertébrés - des ablations importantes de cytoplasme ou
une fragmentation de la blastula sont régulés et
permettent d'obtenir des individus complets). Le rôle des
déterminants est encore flou, comme par exemple celui des ARNm
maternels, des protéines de la vésicule germinative, et
éléments des différents territoires comme celui
du croissant gris ou du plasme germinatif qui donnera naissance aux
cellules germinales primordiales. Les embryologistes
moléculaires y ajoutent l'idée, sans
vérification expérimentale, que ces déterminants
pourraient réprimer le génome de chaque cellule
embryonnaire jusqu'au stade où, suffisamment dilués par
les divisions de la segmentation, l'expression du génome
original de l'embryon pourrait s'exprimer.
Ceci est une vision extrêmement passive du rôle,
lui-même très flou, des déterminants. Il est
probablement plus riche d'essayer de comprendre d'une façon
plus générale le comportement cellulaire comme
résultat d'un comportement autonome et social. On touche
là un point très classique: l'opposition,
peut-être uniquement apparente, entre un
mécanisme qui a tendance à regarder la cellule
comme un ordinateur qui reçoit des données et prend des
ordres après des cellules voisines ou, pire, qui obéit
à un programme de développement déterminé
qu'elle porterait en son nucléoplasme, et un vitalisme
qui préfère parler de comportement, de tendance, de
lois de développement qui sont celles de la progression
autonome, de l'adhésivité cellulaire, de la
cohésion sociale ou encore du comportement social
élémentaire...
2.3 Le système population cellulaire est à la base
de l'organogenèse et semble dominé par le
comportement social des cellules, reflet
du travail de relation
2.3.1 le système population et la progression
autonome
La première étape de l'embryogenèse est donc
le passage du système cellule -zygote (individu
unicellulaire) puis amas de cellules (morula, individu
pluricellulaire)- au système population cellulaire -
l'individu étant composé de plusieurs populations
cellulaires réunies en une gastrula.
Un cellule appartenant à une population
cellulaire (qui initie donc une certaine
différenciation ou spécialisation) perd une partie de
son autonomie ce qui se traduit au niveau de chaque type de
travail:
- du point de vue du travail de relation, son
appartenance à un groupe de cellule détermine, à
partir de sa cohésion et du type de liaisons mises en place
avec les autres cellules (stables ou dynamiques,
étroites-serrées ou lâches, communicantes ou
fermées...) la morphologie du tissu. « En
schématisant beaucoup, la morphogenèse est souvent une
succession de passages de l'état épithélial
à l'état de mésenchyme dissocié et
migrateur pour former ensuite à nouveau un
épithélium ». C'est tantôt le
mécanisme des adhésions qui joue (en
présence d'une ou de plusieurs CAM: cellular adhesive
molecules), tantôt le mécanisme des migrations
(avec des molécules de liaison à la fibronectine)(c.f.
Le Moigne, p 166). D'un point de vue plus interne, une cellule
appartenant à une population présente une
compétence vis-à-vis de tel ou tel signal (les
agents pouvant être des substances chimiques dites
inductrices, des agents tératogènes, une
modification du pH, de la température, une
désorganisation mécanique...): cette capacité
peut être regardée à la fois comme un vestige
d'autonomie et comme une particularité liée à la
population (résultat pour une bonne part de la mémoire
cellulaire). La réponse possible d'une cellule appartenant
à une population à la suite d'une modification de son
environnement dépend donc fortement de cette
mémoire.
- du point de vue du travail de nutrition on peut dire
qu'une cellule appartenant à une population présente un
profil métabolique qui représente à la
fois la spécificité métabolique du tissu
auquel elle appartient (une cellule musculaire synthétise
énormément de myoglobine, d'actine, de myosine... par
exemple) et ses propres capacités d'évolution
(un erythrocyte ne synthétise plus que de
l'hémoglobine, une fois perdu son noyau et une bonne part de
ses organites, sa différenciation en hématie est
irréversible; alors qu'une cellule épithéliale
embryonnaire de la vésicule optique synthétise par
exemple des cristallines qui lui confèrent une
potentialité cristallinienne qui ne sera perdu que tardivement
chez les plupart des vertébrés et peut même
persister cher l'adulte dans quelques groupes d'amphibiens, ce qui
explique la possibilité d'expériences de
transdifférenciation: des cellules de la rétine peuvent
encore se dédifférencier et redonner cristallin dans
certaines conditions expérimentales). On considère
qu'il existe une valeur critique pour chaque substance à
partir duquel le métabolisme ne peut plus cesser sans causer
la mort de la cellule, c'est le seuil de
différenciation. Cette notion est assez claire pour une
seule protéine mais beaucoup plus difficile à envisager
pour un métabolisme particulier en encore moins pour
l'ensemble des activités d'une cellule. Il y a presque
toujours une certaine plasticité
métabolique d'une cellule.
- du point de vue du travail de reproduction, la
capacité à se multiplier peut ou non persister au sein
de la population. Souvent seules certaines cellules, dites
cellules souches, gardent cette capacité au sein de la
population.
Les embryologistes désignent par PROGRESSION
AUTONOME l'automatisme présenté par une
population de cellules embryonnaires qui évoluent, en absence
de toute information extérieure, dans la direction d'une
spécialisation fonctionnelle (ou
détermination). Une population en
retour est défini par un ensemble de cellules issues d'une
même cellule embryonnaire et engagées dans une
même progression autonome. La composante cellulaire de la
progression autonome est ce que Rosine Chandebois appelle le
comportement social élémentaire (CSE),
c'est-à-dire, avec mes mots, le travail de relation, de
nutrition et de reproduction de la cellule au sein de la
population.
Le terme de compétence est utilisé par les
embryologiste pour désigner un état fugace pendant
lequel une cellule ou un groupe de cellules appartenant à une
population et donc engagée(s) dans une progression autonome
est susceptible de passer un seuil de différenciation pour tel
ou tel métabolisme et donc de s'engager dans une autre
progression autonome, sous l'action d'un facteur inducteur
(interaction avec une population voisine la plupart du temps).
Par exemple l'ectoderme dorsal des
vertébrés évolue naturellement par augmentation
de l'adhésivité cellulaire en plaque neurale au contact
(on parle d'induction) de la chorde (l'ectoderme seul
dégénère) (RC, p 32). Ainsi les
progressions autonomes s'enchaînent naturellement au sein de
l'embryon par inductions. Dans certains cas on peut
considérer qu'une seule progression autonome donne naissance
à deux types de tissus différenciés
différents si certaines cellules ne répondent pas
à la même vitesse et surtout au même moment
à l'induction ou à la détermination qui a
enclenché la progression autonome. Par exemple
le mésenchyme de rein donne à la fois des tubules
urinaires et le tissu conjonctif qui les maintien en place selon que
les cellules du mésenchyme ont réussi ou non à
réaliser des condensations (RC p 33).
Les limites de l'action d'un inducteur sont
déterminées, non pas par la zone de contact de celui-ci
avec la population receveuse, mais par la compétence des
cellules qui s'induisent de proche en proche (on parle d'induction
homéogenétique); on pense que plus une cellule est
éloignée de la zone d'induction, plus sa
compétence risque d'être faible, ce qui détermine
un gradient d'induction, lié non pas aux capacités de
l'inducteur mais à la compétence des cellules induites
(RC, p35).
Remarques: on peut perturber, lors du développement,
la progression autonome d'une population cellulaire. Par exemple
- si l'on désagrège les cellules d'une population: la
progression autonome s'arrête et peut reprendre une fois que
les cellules sont reagrégées et s'achever normalement:
.
- si l'on modifie la cohésion entre les cellules d'une
population mais sans les séparer : par exemple si l'on cultive
un fragment de vésicule optique en suspension on obtient une
rétine alors que cultivé sur un support, le même
fragment donne un épithélium pigmentaire; de la
même manière un amas de cellules du mésenchyme du
membre cultivé en suspension donne du cartilage alors qu'il
donne des fibres musculaires s'il est cultivé sur un support
(RC, p 29, voir planche
dans la biblio de ce site).
2.3.2 Le système population et la genèse de la
forme des organes
L'émergence de la forme d'un organe est sous la
dépendance directe de la différenciation
tissulaire, elle même sous la dépendance des
interactions complexes entre les populations appartenant à
l'organe et les populations voisines. On emploie le terme de
réajustement pour désigner les interactions au
sein des populations impliquées dans l'émergence d'un
organe, qui font suite aux déterminations des progressions
autonomes.
Un exemple (RC, p 41-43, figures extraites de l'ouvrage et
modifiées légèrement):
|
Émergence de la forme du
bourgeon de membre chez les Vertébrés
Tétrapodes
|
|
observations
|
expériences
|
interprétations
|
|
le bourgeon de membre contient un mésenchyme
à partir duquel se différencie une calotte
apicale sous-la quelle on distingue une zone d'intense
activité mitotique: la zone de prolifération
apicale puis l'extrémité du bourgeon
s'élargit
on n'observe pas de calotte apicale chez de nombreux
groupes de vertébrés apodes
|
désagrégé et placé en
culture, le mésenchyme engendre des îlots de
précartilage typiques en nombre proportionnel au
volume du tissu prélevé
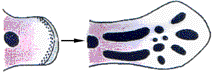
|
le mésenchyme constitue une population
engagée dans une progression autonome qui resserre
les contacts cellulaires; un certain pourcentage de cellules
arrive à se condenser en îlots qui
évoluent différemment de la masse des autres
cellules, dont les contacts ne sont pas assez
étroits
|
|
l'ablation de la calotte apicale empêche
l'émergence du membre
des agents chimiques (comme la thalidomide) ou des mutations
(comme la mutation wingless chez le poulet)
empêchent la croissance de la calotte
si l'on greffe une calotte supplémentaire à
la base du bourgeon on observe une extrémité
supplémentaire
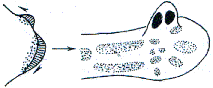
la mutation eudiplopode chez le poulet provoque
l'apparition d'une excroissance portant deux doigts
supplémentaires (d'où le nom de la
mutation)
|
à l'extrémité du bourgeon se
différencie une calotte apicale par induction du
mésenchyme sur l'épiderme
|
|
la calotte apicale induit en retour une activité
mitotique intense dans les cellules du mésenchyme
sous-jacentes (zone de prolifération apicale)
|
|
la mutation eudiplopode chez le poulet resserre
l'adhésion des cellules de l'épiderme de la
calotte ce qui délimite une calotte principale et une
calotte secondaire donnant deux extrémités au
bourgeon: l'une se développe avec deux doigts,
l'autre avec les doigts habituels
|
|
Chez le mutant brachypode de la souris le membre
est anormalement court

le mésenchyme du membre d'une souris
brachypode cultivé un vivo forme des
ilôts de précartilage plus rapidement que du
mésenchyme non muté
des anomalies de même ordre ont été
obtenues en traitant par l'acide rétinoïque des
régénérats de pattes d'Amphibiens
|
la vitesse de la progression autonome peut être
modifiée par des mutations ou des agents chimiques ,
et provoquer une anomalie morphogenétique
|
|
chez les mutants talpid du poulet la
motilité des cellules du mésenchyme est
réduite: elles se condensent avec difficulté
(d'où le nombre plus élevé
d'ilôts de précartilage par unité de
volume et donc une polydactylie) et migrent trop lentement
en direction de l'extrémité du membre
(d'où un membre trop court ressemblant à un
membre antérieur de taupe: talpus)
|
les cellules du mésenchyme sont attirées
par les cellules apicales, on observe donc des
déplacements de cellules du mésenchyme qui
s'accumulent dans l'extrémité du bourgeon qui
s'élargit donc
|
|
la répartition des îlots de
précartilage et donc des futurs os du membre est donc
sous la dépendance d'un gradient proximo-distal (le
nombre d'ilôts est d'autant plus grand que le volume
de mésenchyme est important, ce qui, du fait de
l'élargissement de l'extrémité du
membre, explique la séquence: 1 condensation pour le
stylopode (humérus du bras), 2 pour le zeugopode
(radius et cubitus de l'avant-bras) et davantage pour
l'autopode (carpiens, métacarpiens et phalanges de la
main)...)
|
|
les territoires situés dans la partie externe
entre les îlots de précartilage présent
une cytolyse (apoptose) qui séparent ainsi les
doigts
une fois les doigts individualisés, la croissance
du bourgeon s'arrête, seuls les doigts continuent de
croître, momentanément
|
si la cytolyse ne se produit pas les doigts restent
attachés les uns aux autres (syndactylie); ce qui est
un phénomène normal par exemple chez les
Palmipèdes munis d'une membrane palmaire

l'administration d'aspirine à des fœtus de
souris au 11ème jour de la gestation, provoque la
formation de doigts supplémentaires (en
empêchant la mort cellulaire au niveau de la
calotte)
|
la fragmentation de la calotte, due aux cytolyses des
massifs interdigitaux, provoque l'arrêt de la
croissance du bourgeon; les fragments de calotte encore au
contact des extrémités des doigts permettent
une croissance en longueur de ceux-ci; la croissance se
termine par arrêt de la progression autonome
|
|
La mutation antennapedia de la drosophile
s'exprime à la métamorphose par
l'émergence des structures d'une patte dans
l'ébauche larvaire de l'antenne. Ceci peut
s'expliquer par une activité mitotique trop intense
de la zone sous-apicale de la calotte antennaire. On peut
provoquer cette activité en soumettant des
ébauches à de faibles doses de rayons X ou en
les cultivant dans des conditions qui ajournent la
métamorphose. On peut supprimer cette activité
en appliquant chez le mutant un antimitotique (colchicine)
au stade de la crise épi génétique.
|
Une expérience classique de Holtfreter (1931) citée
dans un ancien livre d'embryologie (Embryologie, Charles Houillon,
Hermann, 1969) conduit à penser que chez les amphibiens la
neurula âgée présente une détermination en
territoires appelés champs
morphogénétiques. Ces territoires avaient
déjà été postulés par Harrison
dans des expériences datant de 1918. sont maintenant
appelés prepatterns et sont considérés
comme étant sous la dépendance
d'homéogènes. Voici quelques éléments de
réflexion.
A la différence des territoires présomptifs de la
blastula, les champs morphogénétiques sont
caractérisés par une détermination qui ne peut
plus faire l'objet de régulation... dans les conditions
expérimentales de cette époque.
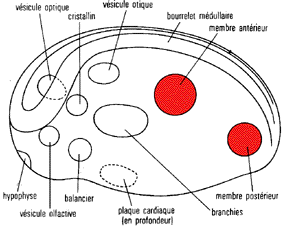
Les "champs morphogénétiques" comme ils étaient
présentés par Houillon en 1969 (p 139) sur une jeune
neurula d'amphibien
(et représentés aussi par Le Moigne en
1989, p 193)
L'ablation de la totalité du champ d'un membre
empêche définitivement l'apparition de ce membre dans la
suite du développement. Ce qui est interprété
dans la cadre de la théorie des champs comme une
détermination acquise définitivement par un territoire.
Pour Rosine Chandebois ce n'est que la calotte apicale et le
mésenchyme sous-jacent qui est enlevé et qui
empêche effectivement le développement du bourgeon de
membre. De la même manière si l'on greffe le territoire
du membre antérieur sur une autre neurula on observe la
formation d'une patte antérieure complète
surnuméraire sur l'embryon receveur. Ce que Houillon
interprète comme un comportement du champ
morphogenétique identique à celui "d'un petit germe
à l'intérieur de l'embryon". Pour Rosine Chandebois
il ne s'agit que d'une induction réalisée par la
calotte apicale supplémentaire greffée (voir cadre
ci-dessus). Houillon note: "pour amputer un germe dès le
stade neurula, il est nécessaire de pratiquer une très
large ablation. Si l'ablation n'intéresse que la moitié
du champ, la partie restante peut, par régulation,
édifier tout de même un membre normal. Le greffon
enlevé et transplanté sur un autre germe édifie
à son tour un membre surnuméraire et même, si ce
greffon se trouve fragmenté en deux éléments,
deux membres surnuméraires s'édifieront. Ainsi,
à partir du même territoire déterminé en
tant que membre antérieur, il est possible d'obtenir par
régulation trois membres complets.» Ces
expériences s'interprètent aussi facilement dans le
cadre de la théorie de Rosine Chandebois à partir d'une
fragmentation de la calotte apicale. L'extension du pseudo champ
morphogenétique étant celui de la population
engagée dans une progression autonome de type membre et
compétente vis-à-vis de l'induction
réalisée par la calotte apicale épidermique.
On présente la neurula comme "une mosaïque de
territoires capables de s'autodifférencier" ou champs
morphogénétiques (Le Moigne, p 193). "Ces
territoires de l'embryon ne représentent pas encore de
différenciations visibles mais représentent
l'ébauche réelle d'un organe". "A
l'intérieur d'un champ, les régulations sont encore
possibles, pendant un certain temps".
La reformulation moderne des champs morphogénétiques en
prepatterns, généralement conçus
comme des gradients de substances morphogènes ne
modifie fondamentalement cette hypothèse ancienne qui consiste
à imaginer que chaque cellule sait à tout instant
quelle doit être son activité en fonction de sa position
par rapport aux autres cellules d'une même structure. A
cette hypothèse Rosine Chandebois oppose plusieurs
arguments:
- la régulation des structures, c'est -à-dire la
régénération après ablation partielle ou
greffe, devrait être possible pendant toute la vie puisque le
prepattern, codé génétiquement (?),
serait une composante de la cellule spécialisée. Alors
que Rosine Chandebois pense que la régulation n'est possible
que dans le cadre de la progression autonome d'une population
embryonnaire, même si, dans certains groupes, cette
faculté puisse persister plus ou moins longtemps.
- la régénération, d'un membre par exemple,
observée dans certains groupes est souvent
interprétée comme étant une régulation
embryonnaire reprogrammée à partir de cellules
spécialisées. Alors que Rosine Chandebois pense que
la partie manquante se reconstitue à partir d'un bourgeon
juxtaposé à la souche, formé par des cellules
retournées à l'état embryonnaire, parfois de la
même manière qu'elle s'est édifiée pendant
l'organogenèse. Éventuellement le
régénérat se complète en imposant un
remaniement de la souche à proximité de la section
(RC, p 13).
- si la régulation des structures était une
propriété de l'embryon persistant parfois chez l'adulte
comment expliquer que certains organismes adultes soient capables de
régénération alors qu'aucune régulation
ne peut être obtenue expérimentalement au début
du développement.
Pour Rosine Chandebois, une intervention microchirurgicale portant
sur une population cellulaire chez l'embryon est souvent, mais pas
toujours, suivi d'une développement normal, ce qui est
qualifié d'une façon générale de
régulation des structures alors que ce n'est pas
forcément le même type de mécanisme:
- on parle de restitution après une ablation
partielle
- d'assimilation, après transfert de l'une de ses
parties dans une autre
- de régulation des excédents si tout ou une
partie d'une population identique lui a été
associée.
Si l'ablation ou la fusion intervient juste après la
détermination et avant le réajustement, il est fort
probable que la morphogenèse se déroule normalement,
sans déficit ni excédent.
Par contre une population de cellules embryonnaires ayant acquis
une certaine organisation est incapable de la réparer. Si
une ablation est réalisée après le
réajustement d'une ébauche la forme est
irrémédiablement perdue. Pour réédifier
un membre disparu la progression autonome devrait se dérouler
dans le même environnement cellulaire que pendant
l'organogenèse. Il faut donc invoquer d'autres
mécanismes pour la régénération.
Remarque:
Il existe un modèle "darwinien" de différenciation
proposé par certains généticiens qui est
fondamentalement opposé de ce que je viens d'expliquer (voir
par exemple La différenciation
cellulaire, Jean-Jacques Kupiec et Pierre Sonigo, Pour la Science,
Dossier "Les sociétés cellulaires", Hors Série,
avril 1998, p 50-53). Ils proposent une
activation des gènes ordonnée linéairement (ce
qui justifierait la colinéarité des gènes du
développement), les types cellulaires seraient ensuite
sélectionnés par des interactions cellulaires. Ils
opposent leur modèle sélectif (qualifié de
modèle "hasard-sélection") à des modèles
instructionnistes (qualifiés de "lamarckiens"), les
gènes étant activés dans l'ordre d'un programme
déterminé, en réponse à des inducteurs
extracellulaires. Mais ce modèle ne va pas contre
l'idée de programme génétique du
développement il se contente d'affirmer que le programme est
dans la colinéarité, ordre des gènes dans le
chromosomes. Ils proposent les modifications de l'ordre des
gènes et des séquences régulatrices
associées comme mécanisme évolutif.
La racine latine
homœo orthographiée homéo
en français viendrait du grec homolos = semblable
et n'est donc pas différente de la racine homo.
Les homéogènes ou gènes
homéotiques ont été définis
chez la drosophile par les travaux de Edward Lewis à partir de
1948 (Edward B. Lewis, Christiane Nusslein-Volhard et Eric F.
Wieschaus ont ainsi reçu le prix Nobel de physiologie et de
médecine en 1995 pour leurs travaux concernant le
contrôle génétique du développement
embryonnaire). Ces gènes "architectes" - comme les a
nommé rapidement le grand public - avaient été
postulés car on observait une modification importante et
reproductible du plan d'organisation de la mouche adulte
(l'homéose ou homéosis
désignant le changement d'une partie du corps en une autre)
à la suite d'une mutation. Des homéoses ont
été décrites bien avant la connaissance des
gènes : on cite notamment William Bateson, qui , en 1894, en
étudiant les variations intraspécifiques chez un
coléoptère, observa notamment l'apparition de pattes
à la place des antennes. Il fit des observations similaires
chez les végétaux, où les étamines
pouvaient par exemple être remplacées par des
pétales. Il n'y a pas de raison, sauf idéologique, de
penser que toutes les homéoses sont d'origine
génétique. Au début des années 1980 David
Hogness et Welcome Bender isolèrent les gènes
Ultrabithorax, Abdominal-A et Abdominal-B chez
la mouche bithorax qui a deux paires d'ailes au lieu d'une
paire d'aile et d'une paire de balanciers
(illustrations sur: http://www.snv.jussieu.fr/bmedia/homeotique/
homeo2.html). Walter Gehring,
Richard Garber, Mathew Scott et Thomas Kaufman, isolèrent
à leur tour les gènes Labial,
Proboscapedia, Deformed et Antennapedia chez la
mouche mutante antennapedia. Rapidement une séquence
particulière isolée d'abord chez antennapedia
fut retrouvée identique dans tous les gènes
homéotiques (d'où le nom, car ils possédaient
tous une partie de séquence semblable) et nommée
homeobox. La grande surprise fut de retrouver cette
homeobox chez la souris puis chez l'homme. Commencèrent
alors des recherches, qui se poursuivent, pour déterminer
où et comment, chez l'embryon, les homéogènes
étaient exprimés et quel pouvait être leur
rôle.
|
Cependant les
homéogènes, dont la définition
repose sur une mutation homéotique, ne
contiendront pas forcément tous cette
homeobox, même si, pour l'instant, c'est le
cas (pour les animaux mais pas pour les
végétaux). En retour, tous les gènes
à homeobox ne sont pas des gènes
homéotiques, ce qui est vrai pour de très
nombreux gènes du développement
(voir par exemple l'entretien avec
Hervé Le Guyader sur le site de
l'inrp:
http://www.inrp.fr/Acces/biotic/develop/controle/html/leguyader.htm
et l'encadré sur le
développement de la
drosophile).
La présence d'une homeobox indique une
fonction (exprimée ou non) de régulation de
la transcription suite à la fixation de
l'homéodomaine sur l'ADN: une protéine
contenant un homéodomaine est donc a priori
supposée être une protéine
régulatrice.
Enfin, il est aussi important d'affirmer que les
homéoses ne sont pas toutes d'origine
génétique et n'impliquent pas forcément
d'homéogènes. Elles peuvent être
provoquées artificiellement chez nombre
d'espèce par des greffes ou des traitements chimiques
à différents stades du
développement.
|
L'homéobox code pour une chaîne de 60 acides
aminés (ou homéodomaine), très peu
modifiée dans les différents groupes où elle a
été isolée (voir schémas
par exemple sur: http://www.snv.jussieu.fr/bmedia/homeotique/
homeo2.html) . Ses 4 domaines en
hélice semblent lui permettre de s'associer à l'ADN
pour réguler son expression; elle reste d'ailleurs dans le
nucléoplasme. Les protéines qui contiennent
l'homeobox (ou plutôt un homéodomaine
fonctionnel) appartiennent ainsi aux protéines de
régulation ou facteurs de transcription. Les
homéogènes dont les rôles ont été
précisés par l'étude du développement
chez la drosophile, par exemple les complexes bithorax ou
antennapedia (du nom des mutations homéotiques
correspondantes), déterminent, d'après certains
généticiens du développement, les
caractères antérieurs des segments de la mouche; ils
les ont qualifiés de gènes sélecteurs
homéotiques. D'une façon plus
générale, les gènes à homéobox
, qui ne sont pas associés systématiquement
à des mutations mais codent pour des protéines faisant
partie des facteurs de transcription, interviennent comme
gènes de positionnement (associés au concept
d'information de position).
Pour essayer d'illustrer (et de clarifier) mes propos je propose
deux étapes:
* l'étude d'un exemple: la formation des
doigts à partir d'articles de La Recherche, de Pour La
Science et de l'ouvrage: Biologie Moléculaire de la
cellule
* un essai de compréhension du développement
de la Drosophile et les interprétations qu'en font les
généticiens du développement
|
Exemple1: De
la découverte des homéogènes à
l'étude génétique de la formation des
doigts
|
|
Les gènes à
homéobox et l'organisation du corps,
Eddy De Robertis, Guillermo Oliver et Christopher Wright,
Pour La Science, 155, septembre 1990, 50-56
Face à des questions aussi controversées
comment un professeur du secondaire peut-il comprendre et
enseigner des éléments aussi contradictoires
par rapport à tout ce qu'il sait déjà ?
Pourrait-on aussi ajouter que les théories des
chercheurs sont parfois masquées comme ici ?
(quelques commentaires en
bleu ont été insérés)
|
La commande de la différenciation
cellulaire
Deux expériences semblent montrer que les
gènes à homéobox activés
commandent directement la différenciation des
cellules embryonnaires (comment
invoquer un mécanisme moléculaire identique
pour tout type de différenciation à tous les
moments du développement, cette simplification
(naïve ?) est pour le moins surprenante).
Dans une première expérience, nous avons
injecté des anticorps anti-protéine XlHbox 1
dans des oeufs fécondés de Xenopus,
c'est-à-dire dans des embryons au stade unicellulaire
(?!!). En se fixant sur
la protéine XlHbox 1, les anticorps l'inactivent
pendant une période cruciale de la
morphogenèse - celle pendant laquelle l'organisation
corporelle s'établit. Chez les têtards qui se
développent ensuite, les tissus qui, dans les
conditions normales, expriment la protéine XlHbox 1
et engendrent la moelle épinière
antérieure, se différencient alors en une
partie postérieure du cerveau. Autrement dit,
l'inactivation de la protéine XlHbox 1 transforme une
partie de la moelle épinière en une structure
plus antérieure (il existe
tant d'autres interprétations possibles: en injectant
une substance toxique à une étape
précoce du développement on ne sait jamais
trop ce qui peut se passer; l'expression de ces gènes
est sans aucun doute nécessaire, à une
étape du développement mais de la à
leur conférer un rôle quasi-magique il y a un
fossé).
Dans une seconde expérience, P. Gruss et son
collègue Michael Kessel ont injecté dans des
embryons de Souris des molécules d'ADN contenant un
gène à homéobox de Souris. Ces
molécules étaient composées de telle
sorte que le gène à homéobox
s'exprimait dans tout l'embryon, même dans des
régions où normalement il ne s'exprime pas,
comme la tête et le cou. Les embryons se sont
transformés en souris qui présentaient souvent
de graves malformations de la tête, comme des fentes
palatines ; les animaux possédaient également
une vertèbre et un disque intervertébral
supplémentaires, à la base du crâne, et
parfois même une paire de côtes dans le cou.
Ainsi chez les Vertébrés, l'expression
anormale d'un gène à homéobox provoque
des malformations homéotiques similaires à
celles qui résultent des mutations chez la Drosophile
(même remarque: le
développement embryonnaire est infiniment plus
complexe que ce que l'on peut supposer à partir d'une
seule expérience de transfert
génétique; l'apparition de malformation
qualifiées d'homéotiques met en
évidence des dérèglements
aléatoires d'un développement
extrêmement complexe).
D'autres travaux indiquent que les gènes à
homéobox déterminent l'identité
cellulaire (!!!). Nous
avons vu que les gènes à homéobox
s'expriment très précocement dans des bandes
successives qui segmentent l'axe
antéropostérieur de l'embryon. Quand ces
bandes se transforment ultérieurement en organes, les
mêmes gènes à homéobox
s'expriment à nouveau très intensément,
comme s'ils « rappelaient » aux cellules, par un
signal moléculaire, leur origine dans l'embryon.
Le développement des membres antérieurs est
exemplaire. Le champ morphogenétique des membres
antérieurs correspond exactement à la bande de
mésoderme qui exprime le gène XlHbox J. Les
cellules de cette bande prolifèrent pour former, chez
Xenopus, un bourgeon de membre antérieur, environ
trois semaines après la fécondation.
A ce stade, le bourgeon du membre antérieur semble
uniforme, mais il présente un « gradient »
de concentration en protéine XlHbox 1 : cette
concentration diminue progressivement du noyau des cellules
antérieures - qui formeront le pouce - au noyau des
cellules postérieures - qui formeront le petit doigt.
Quand le membre s'allonge et prend forme, la concentration
en protéine XlHbox 1 reste supérieure
près de l'épaule (à
l'extrémité proximale du bras). En revanche,
la protéine codée par le gène Hox 5.2,
un autre gène à homéobox, se
répartit selon un gradient opposé : sa
concentration est maximale près de
l'extrémité postérieure et distale du
membre antérieur.
Ces gradients de protéines XlHbox 1 et Hox 5.2 sont
identiques dans les embryons de Crapaud, de Poulet et de
Souris. Par ailleurs, d'autres gènes à
homéobox participent à la formation des
membres antérieurs : D. Duboule a identifié
trois autres gènes à homéobox adjacents
au gène Hox 5.2, et qui s'expriment successivement
quand le membre s'allonge, dans un ordre correspondant
à leur position.
Les gradients de protéines ou d'autres
molécules dirigent efficacement les cellules vers
leurs emplacements définitifs. Guidées par des
quantités variables d'une même protéine,
les cellules d'un bourgeon de membre migrent à des
vitesses différentes et engendrent des doigts
séparés. Ce système de gradient
moléculaire est plus économique que
l'utilisation de plusieurs protéines qui
correspondraient chacune à un doigt.
Ainsi les mêmes gènes à homéobox
organisent l'axe tête-queue du très jeune
embryon, qui guident plus tard les cellules vers leur
emplacement définitif, quand les membres se
développent. Les protéines contenant
l'homéodomaine restent dans les noyaux des cellules,
comme doivent le faire des protéines qui activent ou
inactivent les gènes. Comment s'établissent
les gradients de ces protéines nucléaires dans
les bourgeons de membres ? Les cellules envoient
probablement à leurs voisines des signaux
moléculaires semblables à ceux qui guident
l'organisation de l'axe tête-queue ; les facteurs de
croissance ou l'acide rétinoïque semblent
participer à cette signalisation.»
(Toute cette interprétation
repose sur une l'idée de programme
génétique qui reste sous-entendue: la cellule
obéit à tout instant à l'information
qu'elle possède par son génome; cette
information est progressivement exprimée au cours du
développement; on retrouve dans la disposition
spatiale des gènes et dans la séquence de leur
activation les structures de l'embryon et l'ordre de leur
mise en place...).
|
|
L'origine des doigts, Denis
Duboule et Paolo Sordino, La Recherche, 296, mars 1997, p
66-69
Sept années plus tard, un article qui reste,
à mon avis, dans la même ligne:
|
« Par la méthode d'hybridation in situ,
nous pouvions enfin localiser précisément les
domaines d'expression de chacun de ces gènes
[homéotiques]. Autrement dit, prévoir
où et quand ces gènes interviennent dans le
développement des différents organes. Les
doigts s'étaient-ils développés
à partir d'un élément présent
sur la nageoire ou bien s'agissait-il d'une véritable
innovation morphologique? La génétique et
l'embryologie allaient peut-être nous permettre de
tester les hypothèses des uns et des autres. En
quelques années cette technique s'est effectivement
montrée très performante et nous a permis de
décrypter la fonction et l'action de plusieurs
dizaines de gènes homéotiques au cours des
principales étapes de la morphogenèse des
membres et des nageoires. Ces nouvelles expériences
permirent d'étayer une idée déjà
supportée par les études comparatives des
bourgeons de nageoire et de membre, à savoir
l'existence d'une sorte de bifurcation dans les phases
tardives de leur développement.
Chez les mammifères, les
homéogènes sont regroupés en quatre
complexes HoxA, HoxB, Hoxc et HoxD* (Hox est une
abréviation pour Homéobox) localisés
sur des chromosomes différents(I, II). Très
récemment, dans une étude portant sur la
souris, nous avons constaté que les gènes HoxD
s'exprimaient dans des régions différentes du
membre pendant son développement. Dans une
première phase (correspondant au début du
bourgeonnement), ces gènes s'expriment suivant une
stratégie de poupées russes centrée sur
la partie basse du bourgeon. Dans une seconde phase, lors de
la formation des doigts, leur domaine d'expression
s'étend vers l'extrémité avant et les
bords supérieur et inférieur du bourgeon.
Ce mécanisme est-il observé chez les
poissons ? Pour répondre à cette question il
nous faut d'abord caractériser le bagage
génétique c'est-à-dire identifier les
complexes Hox responsables de leur développement. Par
clonage des gènes Hox d'un petit poisson du Gange, le
poisson-zèbre (le Danio rerio), nous avons
retrouvé les quatre mêmes complexes A, B, C, D,
qui caractérisent donc tous les
vertébrés. Premier élément
important : le passage des poissons aux tétrapodes
n'a donc pas été accompagné d'une
augmentation du nombre de gènes Hox. Sur la base de
cette découverte, nous avons suivi, dans un
deuxième temps l'activation des gènes au cours
du développement de la nageoire pectorale (celle
située à l'avant, homologue à nos bras)
du poisson-zèbre. (Cette
constatation est très générale
concernant l'évolution qui s'est probablement faite
sans augmentation du nombre de gènes, ce qui est un
argument en défaveur du programme
génétique forcément de plus en plus
complexe chez des organismes dont le développement
est de plus en plus long et complexe).
Cette étude a permis de montrer qu'il existait
au stade précoce du développement une grande
similitude entre petit poisson et la souris, les
gènes HoxD s'exprimant essentiellement dans la partie
basse de la future nageoire.
(Voilà une ressemblance
moléculaire fort pertinente mais il ne faut pas
oublier la ressemblance embryologique qui crève les
yeux et qui a une toute autre importance: mêmes
bourgeons, avec du mésenchyme surmonté d'une
calotte apicale...) En revanche, dans le stade
morphogenétique plus avancé, aucune activation
de ces gènes n'est détectée dans la
partie avant et sur les bords inférieur et
supérieur du bourgeon comme c'est le cas chez la
souris. Seule donc la phase précoce d'expression des
gènes HoxD est observée chez les poissons. Il
en est de même des gènes du complexe HoxA qui,
au stade avancé du développement, ne sont pas
activés de la même façon chez les
poissons et les tétrapodes.
Une différence fondamentale dans la phase
terminale de la morphogenèse suggère que les
doigts sont bien des structures nouvellement
formées.
D'un point de vue strictement moléculaire, la
phase I du développement fait donc intervenir les
mêmes gènes aux mêmes endroits chez le
poisson et la souris, ce qui, à notre avis, explique
les similitudes morphologiques (homologie) entre certains
éléments osseux de la nageoire et les trois os
principaux du membre. (Cette
conclusion est aussi un peu surprenante alors que les
auteurs viennent d'expliquer que les mécanismes
anatomiques, histologiques et cytologiques sont
identiques... peut-on faire reposer ces similitudes sur une
étude moléculaire ?) En revanche, la
nageoire semble être dépourvue de la phase
terminale présente dans la morphogenèse des
membres. Cette différence fondamentale suggère
que les doigts sont bien des structures nouvellement
formées. Les poissons pourraient-ils fabriquer des
doigts ? Il est probable qu'ils en ont bel et bien le
potentiel génétique mais qu'ils en sont
empêchés au stade avancé du
développement. (Vous
pardonnerez cette remarque mais on a vraiment l'impression
de se trouver en face d'un élève borné:
pourquoi imaginer un programme commandant une structure
alors que les conditions du développement suffisent
à expliquer les différences entre les deux
types de membres? ...Faire fabriquer des doigts à un
bourgeon de téléostéen ne semble pas
irréalisable si l'on pouvait contrôler la
prolifération et l'adhésivité
cellulaire du mésenchyme et reproduire les
inductions...). Seule responsable de leur
évolution morphologique, la machinerie
génétique a choisi pour eux la solution
«nageoire». (id.)
Peut-on pour autant en conclure que ces choix
génétiques sont les véritables
initiateurs du passage de la nageoire au membre il y a
environ 380 millions d'années ? Posé de cette
façon, le problème reste entier. Les
mécanismes moléculaires que nous avons
décrits constituent une solution possible. Mais si
cette solution est bien la bonne, quel scénario
évolutif pouvons-nous proposer ? Il semble que le
facteur déterminant du choix entre les rayons
flexibles et les doigts soit le moment précis auquel
la croissance du bourgeon diminue, suite au repli de la
couche ectodermique. Il s'agirait donc d'une illustration
très réussie d'un mécanisme
d'hétérochronie* par
lequel un temps - celui du repli détermine la
structure finalement produite : le repli est précoce
et les rayons apparaissent, le repli est tardif (ou
inexistant) et les doigts
apparaissent.(Voilà une
remarque très intéressante:
l'hétérochronie qui nous vient de la
paléontologie est une présentation des
variations chronologiques d'apparition de structures ou de
fonctions chez des organismes voisins; elle s'intègre
parfaitement à mon avis à la théorie de
Rosine Chandebois; j'ai essayé d'en dire quelques
mots dans le cours
de paléontologie:
3.a.2) Une
innovation morphologique qui aurait
précédé de plusieurs millions
d'années la colonisation de la terre
ferme.»
|
|
exemple d'expérience issu de
Biologie moléculaire de la cellule,
Alberts et al., Flammarion, Médecine-Sciences, 1994,
p 1064 (fig 21-35).
|
Une expérience de greffe d'un fragment
mésodermique du bourgeon de la patte sous la calotte
apicale du bourgeon de l'aile du poulet (d'après
J.W. Saunders et al., Dev. Biol. 1/281-301, 1959): l'aile
obtenue comporte un stylopode et un zeugopode resté
embryonnaire avec respectivement un et deux os; l'autopode
est différencié de façon anormale avec
deux doigts.
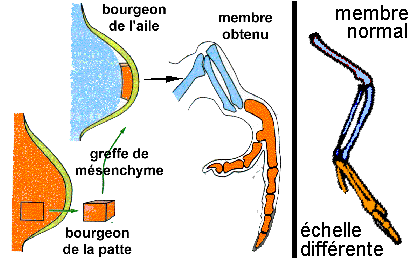
D'après fig 21-36 de Biologie
moléculaire de la cellule, Alberts et al.,
Flammarion, Médecine-Sciences, 1994, p
1064
La légende de la figure (partie de gauche) est:
le tissu destiné à devenir une cuisse,
greffé à l'extrémité d'un
bourgeon d'aile de poulet, se transforme en orteil.
L'interprétation proposée est la suivante:
« Cette expérience montre que les cellules
précoces sont déjà
déterminées en tant que patte et que, en
dépit de leur détermination, elles n'ont pas
encore reçu l'attribution de leurs valeurs
de position détaillées le long de
l'axe du membre et peuvent répondre à des
signaux dans l'aile de façon à former
l'extrémité d'une patte au lieu de sa base. Le
système de signalisation qui contrôle les
différentes parties d'un membre est apparemment
identique pour l'aile et la patte. La différence
entre les deux membres résulte d'une
différence dans l'état interne des cellules au
début du développement du membre. Même
si les cellules semblent identiques et sont destinées
à donner naissance au même assortiment de types
cellulaires différenciés, elles ne
sont pas équivalentes et ont des
valeurs de position différentes. De cette
manière la spécification finale du
comportement d'une cellule de membre est
réalisée de façon combinatoire : en
premier lieu elle reçoit l'information qui lui
indique si elle est une cellule de patte ou d'aile ;
des signaux à l'intérieur du bourgeon
du membre en cours de croissance déterminent
ensuite des composants de résolution plus fine de
valeur de position, reflétant sa position
précise à l'intérieur du membre.
»
Ce concept de valeur de position
est fort controversé, notamment par certains
embryologistes, car il ne correspond à aucun
mécanisme informatif connu: comment une cellule
peut-elle connaître sa position dans un membre qui
n'existe pas encore si ce n'est toujours en se
référant à un programme
déterminé ? A ce concept des embryologistes
comme Rosine Chandebois opposent une détermination
qui provoque la progression autonome d'une population, les
inductions et les réajustements. La greffe
pratiquée prouve que la progression autonome de type
patte et de type aile n'est pas la même donc qu'il y a
bien une détermination, qui est celle de la
population pour l'embryologiste et non celle de la cellule.
Cette détermination n'est pas simple à
expliquer si l'on essaye de le faire a posteriori comme ici.
Par contre, sans chercher une causalité
évolutive, il est facile de relier le devenir de
telle ou telle population à son environnement. Chez
les oiseaux le membre antérieur présente un
développement retardé (se développe un
peu plus tardivement) puis accéléré
(croissance rapide) par rapport au membre postérieur.
La progression autonome des cellules du mésenchyme
des deux bourgeons n'en est pas au même stade à
un instant donné. Il n'y a pas de
nécessité d'invoquer une connaissance de son
devenir pour une population donnée. Le membre
"chimère" obtenu s'explique fort bien par les
mécanismes invoqués dans le cadre
précédent.Une première question
fondamentale est de savoir pourquoi, s'il y avait un
programme de développement au sein des cellules,
aucune ne le mène à terme puisque le membre
obtenu n'est ni une aile ni une patte.
L'interprétation comme un doigt greffé sur une
partie de type aile est de plus fort tendancieuse et
même pour un non spécialiste, peu convaincante.
Le stylopode et le zeugopode de l'aile ne se
développent plus normalement, ce qui peut
s'interpréter comme une induction inadéquate
ou insuffisante du tissu greffé ou de la calotte,
éloignée de son mésenchyme sous-jacent
par la greffe. Il faut aussi noter que le mésenchyme
normal situé auparavant directement sous la calotte a
continué sa progression autonome dans une autre
direction puisqu'il n'a pas donné l'autopode qu'il
aurait du donner (à moins que le nouvel autopode soit
lui-même chimère) mais qu'il a
été en quelque sorte "reprogrammé", si
l'on utilise les termes courants, pour donner des
éléments du zeugopode. Par contre, l'induction
de la calotte sur le mésenchyme greffé
pourrait être qualifiée d'excessive et
provoquer ainsi l'apparition d'un nombre réduit de
doigts par allongement excessif de l'extrémité
du bourgeon. (Je
précise que je n'ai pas les compétences pour
analyser comme un embryologiste ces expériences dont
je n'ai que des retranscriptions partielles, mais je tiens
cependant à essayer de comprendre)
|
|
Comment se construisent les doigts
? Yann Hérault et Denis Duboule, La
Recherche, 305, janvier 1998, 40-44
un article avec le même auteur que l'article
précédent de La Recherche sur le sujet mais
une toute autre vision à mon avis... (10 ans plus
tard voir une conférence de ce même auteur :
http://www.
college-de -france. fr/media/ phi_sci/UPL31 752_2008 _03_20
Duboule.pdf)
Les figures extraites
de l'article sont volontairement modifiées afin de
n'être utilisables que pour la seule illustration sans
copie possible....
|
« Il est inutile de chercher "les gènes
des doigts" : ils n'existent pas. Ceux qui ont
été identifiés à ce jour sont
aussi impliqués dans la genèse du
système nerveux central ou du système
uro-génital. La transformation d'un bourgeon
cellulaire en un membre doté d'un bras, d'un
avant-bras et d'une main à 5 doigts est un superbe
exemple du bricolage de l'évolution, des contraintes
imposées aux formes des organismes... et de
l'étendue des problèmes de morphogenèse
qui restent à résoudre. Il est probablement
vain de disserter sur l'utilité d'avoir cinq doigts
plutôt que trois ou quatre.
Au hit-parade des structures ayant joué un
rôle important au cours de l'évolution, les
doigts se trouvent certainement en bonne place. En effet,
ces outils extraordinaires ont participé de
façon essentielle à la colonisation du milieu
terrestre, il y a plus de 350 millions d'années : les
premiers vertébrés tétrapodes munis de
doigts étaient très vraisemblablement
aquatiques. Plus tard, ils ont sans doute contribué
à l'acquisition de fonctions intégrées
complexes, notamment au travers des changements de posture
liés à une étape cruciale de notre
phylogenèse : la libération des membres
antérieurs des contingences liées au
déplacement. En outre, les doigts (et les membres en
général) représentent un exemple
particulièrement parlant d'adaptations
réussies à des contraintes très
variées. Ainsi, le cheval court sur un doigt, la
vache sur deux, un oiseau vole grâce à des
ailes issues de trois doigts (mais marche avec quatre ou
deux doigts, selon qu'il est poulet ou autruche), alors que
noue pentadactylie nous autorise en principe des
activités plus diverses. Pourtant, cette
diversité de formes masque une grande unité
dans les mécanismes développementaux
sous-jacents, reflétant ainsi le paradoxe apparent du
néodarwinisme : faire du différent à
partir du semblable. Chez les humains, la construction de
ces mécaniques de précision ne va pas sans
poser problème : les malformations
congénitales des membres affectent près de 7
enfants sur 10 000. Pour la plupart, elles dérivent
de modérations des devenirs cellulaires au cours du
développement embryonnaire. La détermination
de l'origine moléculaire de ces pathologies,
longtemps restée énigmatique, est aujourd'hui
possible suite à des études menées sur
les rongeurs. On commence à entrevoir
l'avènement d'une véritable
génétique de la digitation, nous permet, tant
de comprendre les secrets de la fabrication des
extrémités des membres et, par
conséquent, les modifications qui y furent
apportées au cours de l'évolution.
On observe des similitudes étonnantes entre
certaines anomalies congénitales humaines et des
phénotypes produits expérimentalement chez
l'animal. Elles découlent des homologies entre les
structures squelettiques dites appendiculaires des
vertébrés tétrapodes. En effet, les
membres des vertébrés supérieurs sont
tous construits sur la base d'un plan unique, dont les
multiples éléments peuvent être reconnus
d'une espèce à l'autre. Ainsi, on distingue
principalement trois parties dans le plan d'organisation du
membre antérieur : le bras (ou stylopode), soutenu
par l'humérus, l'avant-bras (ou zeugopode)
constitué du radius et du cubitus, et la main (ou
autopode) qui rassemble les os du poignet et des doigts.
Trois axes principaux permettent d'orienter le membre et de
repérer ses différents éléments
dans l'espace : l'axe proximo-distal qui s'étend de
l'épaule aux phalanges, l'axe
antéro-postérieur, que l'on peut suivre du
pouce vers l'auriculaire, et l'axe dorso-ventral,
perpendiculaire à la paume de la main.
Les homologies entre les membres des
vertébrés ne sont pas seulement visibles au
niveau de l'organisation finale. Des études
embryologiques ont mis en évidence la conservation de
la séquence de formation du membre. Chez les
tétrapodes amniotiques - dont nous faisons partie -
la mise en place des éléments du futur
squelette suit une séquence spatiale et temporelle,
conservée et bien définie, faite de
condensations spontanées, de segmentations et de
branchements. Une analyse embryologique comparée de
ce processus suggère que l'axe principal du membre
passe par le bras, l'avant-bras, puis s'infléchit
antérieurement pour former la main. C'est un axe
dynamique établi sur les apparitions progressives des
foyers de condensation des cellules qui donnent naissance
aux éléments osseux du membre. La conservation
de cette séquence d'apparition des foyers
précartilagineux chez les différents
tétrapodes, ainsi que les similitudes morphologiques,
permettent d'envisager une généralisation des
connaissances acquises dans plusieurs systèmes
d'études.
Chez la souris, les membres émergent du tronc
sous la forme d'une excroissance cellulaire appelée
« bourgeon appendiculaire », dont la forme
première est relativement simple. Au bout de quelques
jours, cette structure présente une organisation
quasi identique à celle du membre de
l'adulte.
Le bras est déterminé et
fabriqué le premier l'avant-bras ensuite, puis la
main ; nos mains sont plus jeunes que nos bras
Le développement de ce bourgeon dépend
de deux phénomènes essentiels qui adviennent
au niveau de la partie distale : la prolifération et
l'organisation des cellules. Ces deux aspects de la
formation du membre ont souvent été
considérés comme relativement
indépendants, mais il apparaît de plus en plus
évident qu'ils sont étroitement liés,
en particulier au niveau de leur contrôle
génétique.
Les bourgeons appendiculaires sont des structures
très finement organisées. Différentes
régions ont été identifiées lors
de l'étude de la morphogenèse des membres du
poulet. Chacune de ces régions possède un
rôle spécifique, tout en interagissant avec ses
voisines lors de la formation du membre. Ainsi, dans la
partie terminale du bourgeon, on distingue un repli de
cellules à la surface formant la « crête
apicale ectodermique» (RER,
la calotte apicale). Cette
structure distale maintient la prolifération des
cellules localisées en dessus, dans la « zone de
progrès » (Pz). Une troisième aire,
située postérieurement, la « zone
d'activité polarisante» (ZPA), est
impliquée dans l'établissement de la
polarité antéro-postérieure.
Après avoir quitté la zone de progrès
au cours du bourgeonnement du membre, les cellules perdent
leur capacité de croissance et commencent à se
différencier. Elles forment des condensations
précartilagineuses qui se diversifieront pas la
suite, soit par branchements, soit par segmentations, pour
donner les éléments squelettiques en suivant
l'axe majeur du membre. Une des caractéristiques
principales de la formation du membre découle de ce
phénomène de croissance apicale : le bras est
déterminé et fabriqué le premier,
l'avant-bras ensuite, puis la main.
Morphogénétiquement parlant, nos mains sont
plus jeunes que nos bras.
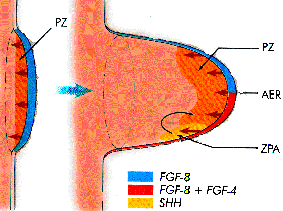
fig 3 (légèrement
modifiée) - Représentation
schématique du membre antérieur de poulet en
développement
à un stade précoce et au stade plus
tardif du bourgeon, possédant une crête apicale
ectodermique (AER), une zone de progrès (PZ) et une
zone d'activité polarisante(ZPA). Au stade
précoce commence la sécrétion du
facteur FGF-8 par les cellules de l'extoderme sus-jacent
(futur AER), qui va activer le gène ssh dans la
partie postérieure (ZPA) du bourgeon. Une cascade
s'ensuit, entraînant la synthèse de FGF-4 au
niveau de l'AER.
Les facteurs qui contrôlent la croissance du
bourgeon ont été identifiés au cours de
ces dernières années. Le facteur de croissance
FGF-8 («Fibroblast Growth Factor 8 ») est un des
acteurs initiaux. Sécrété par les
cellules de la crête apicale, il maintient la
prolifération des cellules de la zone de
progrès par la synthèse d'autres facteurs de
type FGF, et intervient également dans l'induction de
la zone polarisante. Celle-ci va synthétiser en
retour le produit du gène sonic hedgehog
(shh), médiateur de la polarisation
antéro-postérieure. D'autres protéines
sont synthétisées par les cellules
ectodermiques. Ainsi, ENGRAILED-1 et WNT-7a sont
impliqués respectivement dans la détermination
des faces ventrales ou dorsales des membres. Des
interactions entre les cellules des faces dorsale et
ventrale résulte alors la synthèse de la
protéine R-FRINGE et la formation de la crête
apicale. L'ensemble de ces molécules participe
à un réseau coordonné de signaux qui
définit les trois axes de symétrie du membre.
Ainsi, la sécrétion de FGF-4 dans la partie
postérieure de la crête apicale,
associée à la synthèse de WNT-7a par
l'ectoderme dorsal du bourgeon, maintient la production de
shh dans la zone polarisante. Cette
protéine stimule en retour la production de FGF-4,
établissant ainsi une boucle de rétroaction.
Cet ensemble de signaux a pour conséquence la
stimulation et la maintenance de l'expression des
gènes architectes.
Les gènes architectes des membres des
vertébrés appartiennent à la famille
des homéogènes, ou
gènes Hox. Ils codent des
protéines qui régulent l'activité
d'autres gènes. Les gènes Hox sont
regroupés en quatre complexes indépendants,
situés chacun sur un chromosome particulier. Ces
groupes sont certainement apparus lors de duplications d'un
complexe ancestral semblable à celui qui existe
actuellement chez les céphalocordés, comme le
lancelet. Comme conséquence de ces duplications, les
gènes, localisés à la même
position au sein de complexes différents,
présentent d'importantes homologies de
séquence : ils définissent treize
sous-classes, ou « groupes de paralogies ». De
plus, l'activation de ces gènes est
réalisée séquentiellement en suivant
l'ordre des gènes le long du chromosome, et leur
domaine d'expression est de plus en plus restreint. Les
gènes des sous-groupes de paralogie 9 à 13
sont exprimés au cours de la morphogenèse des
membres. Ainsi, les gènes Hoxa-9 et Hoxd-9 sont
exprimés dès l'apparition du bourgeon, alors
que les gènes du groupe 13 sont activés plus
tardivement dans la partie postérieure, au niveau de
la zone de progrès. Les domaines d'expression des
gènes Hoxd s'étendent plus
antérieurement dans les parties les plus distales,
tout en conservant une polarisation
antéro-postérieure, contrairement aux aires
d'expression des gènes Hoxa. Ces données
descriptives sur l'expression des gènes Hox,
corrélées à la fonction de leurs
homologues ancestraux chez la drosophile laissaient penser
qu'ils devaient jouer un rôle primordial dans
l'établissement du patron du membre chez les
vertébrés. Les manipulations
génétiques ont permis d'estimer leur
importance réelle dans la morphogenèse du
membre et de poser les bases d'une étude
fonctionnelle des gènes. Le rôle des
gènes Hox des groupes 9 à 13 dans la
modélisation du membre a été clairement
démontré par cette approche. Des mutations
conduisant soit à l'inactivation, soit à la
modification d'une fonction HOX donnée ont
été produites artificiellement dans trois
laboratoires, dont le nôtre, à Genève.
En règle générale, ces mutations
induisent des modifications du squelette appendiculaire, qui
sont réparties suivant une orientation
proximo-distale dans les différents segments du
membre. Cette répartition dépend de
l'étendue du domaine d'expression du gène
muté et, par conséquent, de sa position au
sein du complexe. Un gène exprimé de
manière précoce dans un domaine proximal
(comme Hoxd-9) aura une fonction déterminante dans la
modélisation du bras, alors qu'un gène
exprimé tardivement dans un domaine distal (comme
Hoxd-13) aura un rôle majeur dans la formation de la
main. De plus, il existe des redondances de fonctions entre
gènes d'un même groupe. Ainsi, chez des souris
double-mutantes (ayant une double mutation) pour les
gènes du groupe 11, Hoxa-11 et Hoxd-11, le radius et
le cubitus sont quasiment absents, alors qu'une seule copie
sauvage d'un de ces gènes dits paralogues est capable
de préserver la formation de l'avant-bras. De
même, la double inactivation des gènes du
groupe 13 conduit à l'arrêt de là
formation de la main alors que, chez les simples mutants de
ces deux gènes, la plupart des éléments
de la main sont correctement formés.
|
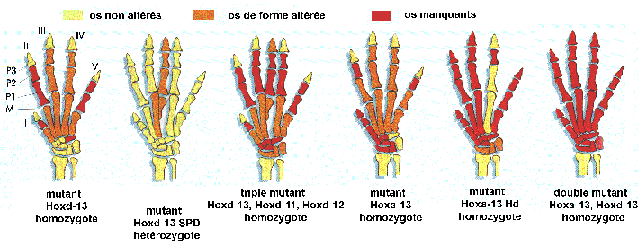
D'après fig 4.
Représentation schématique et comparaison des
altérations du squelette de la main, suite à diverses
mutations de gènes homéotiques.
|
SUITE
Comment se construisent les doigts
? Yann Hérault et Denis Duboule, La
Recherche, 305, janvier 1998, 40-44
|
La corrélation entre domaines d'expression et
localisation des altérations chez les mutants des
gènes Hox est évidente au niveau du bras et de
l'avant-bras. Dans ces deux segments du membre, les
gènes ont des fonctions sensiblement
équivalentes. Cependant, au cours de la
morphogenèse de la main, les interactions entre les
différents gènes ne sont pas simplement
synergiques. En effet, dans cette partie du membre où
de nombreux gènes sont exprimés, il existe une
hiérarchie fonctionnelle des gènes Hox suivant
leur position relative sur le complexe. Ce principe se
caractérise par le rôle dominant des
gènes du groupe 13 sur la fonction des autres
gènes. Ainsi, un simple mutant des gènes des
groupes 11 ou 12 aura des mains moins altérées
qu'un mutant pour un des gènes du groupe 13. Ces
études révèlent la position
hiérarchique dominante du gène du groupe 13
dans la modélisation de la structure finale de
l'autopode. Elles suggèrent aussi que tous les
paralogues de 11 à 13 sont recrutés afin de
modéliser la partie terminale du membre, la plus
complexe dans son organisation : la main.
Il semble bien que les produits des gènes
hox interviennent non seulement dans le contrôle des
voies de prolifération cellulaire, mais aussi dans
celui des voies de condensation et de segmentation. Dans
cette perspective, l'action des produits des gènes
pourrait conduire une condensation précartilagineuse
à se diviser par branchement sous l'effet d'une
augmentation locale du nombre de cellules. De même, il
pourrait entraîner l'arrêt
prématuré d'une condensation par une
diminution du nombre de cellules. L'activation progressive
des gènes Hox dans des sous-populations cellulaires
du membre pourrait engendrer un patron précis de
condensation en fonction des masses cellulaires à
disposition. « L'identité», d'un
segment du membre semble être fixée par des
petites variations dans l'équilibre de l'information
à l'intérieur du même plan de
construction, et par la mise en oeuvre progressive de
nouveaux gènes. La genèse d'un membre ne
se fait pas à partir d'un système de
coordonnées cartésiennes définissant
les structures comme des pions sur un échiquier, mais
plutôt selon un référentiel dynamique
avec trois dimensions spatiales et une temporelle.
(Voilà une
définition du rôle des homéogènes
dans le développement qui est tout-à-fait
compréhensible dans l'optique
développée dans ce cours)
La découverte récente, chez l'homme et
la souris, du fait que plusieurs syndromes résultent
de mutations de certains gènes Hox, démontre
de façon éclatante l'importance de ces
gènes pour l'ontogenése d'une digitation
normale. Ainsi, une mutation dans le gène Hoxd-13 est
liée à un type de synpolydactylie (SPD) chez
l'homme. Cette maladie génétique humaine se
caractérise notamment par une déformation
congénitale de la main et se transmet comme un trait
autosomal dominant . Une autre mutation humaine, affectant
le gène Hoxa-13 a été décrite
dans le syndrome main-pied-génital (MPG). Les
individus atteints de ce syndrome à l'état
hétérozygote présentent des
malformations de la main et du poignet qui ressemblent au
phénotype des souris portant la mutation hypodactyle
(Hd). Cette mutation engendre, par contre, un
phénotype beaucoup plus sévère à
l'état homozygote: les rares animaux Hd/Hd survivant
jusqu'à la naissance ne possèdent en effet
qu'un seul doigt. Il a également été
démontré que cette mutation affecte le produit
du gène Hoxa-13. Dans ces trois mutations naturelles
de gènes Hox, les pièces du squelette
altérées sont localisées au niveau des
zones de fonction des gènes Hoxa-13 et Hoxd-13. En
particulier, ces zones sont identiques dans le syndrome MPG
et lors de l'inactivation du gène Hoxa-13 chez la
souris. Au niveau moléculaire, la mutation du
syndrome MPG est une véritable perte de fonction de
la protéine HOXA-13, similaire à celle
réalisée expérimentalement chez la
souris. Par contre, les phénotypes des mutations
naturelles SPD et Hd sont beaucoup plus importants que ceux
des mutants homozygotes des deux gènes
concernés. L'analyse moléculaire a
montré qu'il ne s'agit pas dans ces deux cas
d'inactivation simple de la fonction des gènes Hox.
Néanmoins, il est tout à fait remarquable que
le phénotype associé aux
extrémités des patients souffrant du syndrome
de synpolydactylie ressemble fortement à celui obtenu
chez des animaux ayant une triple inactivation des
gènes Hoxd-11, Hoxd,-12 et Hoxd-13,
réalisée au sein de notre équipe par J.
Zakany . Ceci suggère que la synpolydactylie humaine
pourrait être causée par l'inactivation
simultanée de plusieurs gènes Hox,
probablement par la production d'une protéine HOXD-13
rendue dominante
négative[un gène
est dominant négatif s'il arrive toujours à
exercer une partie de sa fonction mais d'une manière
incomplète, même quand le gène est
hétérozygote, et si cette fonction partielle
est incapable d'inhiber la fonction d'autres
protéines] par la mutation.
La liaison entre une mutation au
niveau d'un gène homéotique et un
phénotype que ce soit chez la souris ou chez l'homme
reste pour moi encore extrêmement floue. Des tas de
questions auxquelles je n'ai pas de réponse
m'empêchent de comprendre. Par exemple: comment
obtient-on des mutants ? (voir les articles suivants)
Comment s'assure-t-on des caractères
(anatomo-physiologiques) de la mutation portée, de
son extension, d'éventuelles autres anomalies ?
Peut-on vraiment dire que les individus qui sont
appelés ici mutants Hoxa-13 par exemple ne sont
"anormaux" que par ce trait génétique et n'ont
d'anormal phénotypiquement qu'une malformation de la
main ? (une réponse est apportée par l'article
suivant pour les souris) Si je comprends assez bien ce que
représente un génome d'unicellulaire comme une
bactérie ou une levure et qu'une culture puisse
comporter des mutants dont on a la maîtrise
phénotypique et génotypique, j'avoue ne pas
comprendre ce que cela veut dire pour un mammifère
composé de milliards de cellules dont on ne"
connaît pas" le génotype (connaître non
pas au sens de la théorie mais au sens de
l'expérimentation), ni vraiment le phénotype
(et si ces termes ont un sens pour une cellule
isolée). En effet, l'idée que chaque cellule
ayant le même génotype puisse exprimer la
mutation , étant issue du seule zygote par mitose, ne
me satisfait pas vraiment, du fait d'une incontestable
modulation cellulaire de cette information
génétique par chaque cellule; les gènes
homéotiques dans cet article sont bien
présentés comme multifonctionnels (les
gènes d'une cellule eucaryote ne sont pas si nombreux
qu'il puisse y avoir des gènes spécifiques
pour la main, d'autres gènes étant
activés si c'est une cellule appartenant au pied par
exemple... ) et donc ils doivent être mis en
œuvre dans d'innombrables autres cellules que celles du
membre antérieur.... Donc, ces gènes
étant multifonctionnels, s'il n'y a pas
d'altération alors que ces gènes sont
défiscients, c'est que d'autres gènes ont
été activés à leur place, pour
un résultat équivalent (?)...Ainsi, une
altération a pu être cachée au cours de
l'embryogénèse ou au contraire
apparaître du fait d'un autre facteur.... Enfin, pour
que l'on puisse parler d'homozygotie ou
d'hétérozygotie, on fait
référence à une
hérédité mendélienne, à
l'aide de souches pures... et je ne conçois pas cela
comme réellement possible pour ce genre de
gènes... mais peut-être suis-je trop
méfiant (une réponse partielle est fournie
aussi dans l'article suivant). N'ayant pas de
réponses à ces questions pour l'instant, je
vais essayer de présenter d'autres résultats
sur la drosophile qui seront peut-être plus
documentés.
Les phénotypes observés chez l'animal
après mutation d'un gène particulier
impliqué dans la construction des doigts sont rares
chez les humains
Dans un tel schéma explicatif, la
protéine produite serait non seulement inactive, mais
de surcroît empêcherait l'activité des
protéines HOX voisines, provoquant ainsi une perte de
fonction de plusieurs protéines. Dans ce cas
précis, l'analyse des souris mutantes, ainsi que des
années de travail sur la régulation de ces
gènes, ont permis de proposer une base
moléculaire à l'apparition du syndrome
génétique humain, démontrant une fois
de plus l'utilité de ces modèles animaux.
Il est intéressant de constater que les
phénotypes observés chez l'animal après
mutagenèse d'un gène particulier
impliqué dans la construction des doigts, sont rares
chez les humains. Ce déficit de mutation naturelle,
identique aux pertes de fonctions totales artificiellement
produites chez la souris, est certainement dû à
la multitude de fonctions dans lesquelles ces gènes
sont impliqués au cours de l'embryogenèse. Il
n'existe pas de gènes des doigts. Dés
lors, les pertes de fonctions des différents
gènes Hox ont des effets pléiotropiques
[une mutation
pléiotropique s'exerce sous plusieurs formes
différentes]. Ces gènes
étant notamment exprimés dans le tubercule
génital et le sinus uro-génital, leur
inactivation affecte les capacités de reproduction ou
de gestation des animaux mutants. De même, les
patients atteints de MPG présentent de graves
altérations du système uro-génital. Les
gènes Hox contrôlent également la
formation du système digestif. Leur dysfonctionnement
se traduit alors par l'apparition de pathologies
spécifiques comme dans le cas de Hoxd-13. Dans le cas
extrême de Hoxa-13, l'effet de la mutation sur la
digitation adulte est difficile à estimer car les
souris homozygotes meurent in utero pour des raisons encore
obscures. Ces effets pléiotropiques ont des
conséquences néfastes qui devraient conduire
à une sélection négative d'une
éventuelle mutation conduisant à une perte de
fonction totale. C'est vraisemblablement pour cette raison
que les mutations existantes chez les humains ont souvent
une origine moléculaire complexe (recombinaison
inégale, translocation, mutation de
régulation) donnant lieu à des inactivations
partielles, ou encore à des gains de fonction. Dans
ce domaine, la nature est plus imaginative que
l'expérimentateur.
Néanmoins, de tels effets sont parfois
observés dans les syndromes associés à
d'autres gènes impliqués dans la croissance du
bourgeon. Ainsi, dans les syndromes dits de Crouzon, d'Apert
ou de Jackson-Weiss, les anomalies des membres sont
associées à de nombreuses malformations
importantes (par exemple de la face ou de la soudure des os
de la boîte crânienne). Ces syndromes sont dus
à des mutations des récepteurs qui
médient l'action des facteurs de type FGF, par
exemple FGF-4 ou FGF-8. De même, la voie de
signalisation stimulée par le gène shh est
modifiée dans le syndrome de Smith-Lemli-Opitz, qui
se caractérise par des modifications importantes du
squelette appendiculaire, du crâne et d'autres organes
internes. Les inactivations, réalisées chez la
souris, des autres molécules impliquées dans
la croissance du bourgeon des membres (FGF-4, WNT-7a, En-1,
un des récepteurs au FGF ou au shh) ont montré
qu'elles sont nécessaires au développement
d'un embryon viable. Les formes naturelles des mutants de
ces gènes sont donc là encore, comme dans le
cas des mutations spontanées des gènes Hox,
des mutations plus complexes que de simples pertes de
fonctions, mutations dont les effets sur la digitation ne
sont pas clairement établis. Ce problème,
lié à la multifonctionnalité des
gènes Hox, n'est pas restreint à cette
famille de gènes, et semble bien être une des
clés nécessaires à notre
compréhension de la genèse des formes
biologiques. En effet, il est maintenant bien établi
que les contrôles du développement n'ont que
très peu de spécificité spatiale.
Par exemple, un gène de l'index n'existe pas, de
même qu'un gène de la main. Les gènes
impliqués dans la formation de l'index et de la main
sont tous utilisés dans d'autres contextes, au
détour d'une autre structure. Ceci est dû
à la mécanique même de
l'évolution, basée avant tout sur la
réutilisation et le redéploiement de
structures et de fonctions préexistantes. Ce
bricolage de l'évolution, selon le mot de
François Jacob, entraîne nécessairement
une interdépendance génétique entre
toutes nos fonctions, ce qui rend leurs modifications
toujours plus compliquées. Le gène shh, par
exemple, recruté à maintes reprises dans
différents systèmes, semble non seulement
être indispensable au développement de la main,
mais également à celui du système
nerveux central, de l'intestin, etc. La modification de son
expression dans la genèse de la main serait
certainement source de variations morphologiques
intéressantes, mais l'éventail de ces
variations est restreint par les fonctions de ce
gène, un changement à haute valeur adaptative
dans la main pouvant se traduire par une perturbation
mortelle dans le cerveau.
Cette approche théorique n'est pas
facilement intégrable dans une vue strictement
néodarwinienne de l'évolution
Ceci amène à la notion de contraintes
internes au système et oblige à penser
différemment le problème du
déterminisme de la forme biologique. En effet, la
multi, fonctionnalité des gènes restreint
sévèrement la capacité d'une structure
isolée à évoluer en dehors du contexte
global auquel elle appartient. Dès lors, la forme de
la main n'est peut-être pas en soi un facteur de
sélection critique, et il est évident que la
pentadactylie n'est pas une formule magique. Au contraire,
il est probable que cette formule pentadactyle soit
fixée par des critères
génétiques qui ne sont pas directement
impliqués dans la structure de la
main( et pourquoi pas des
critères spatio-temprorels dus à la
progression autonome... ?). Ainsi, nos cinq doigts
sont-ils peut-être la conséquence de la
nécessité impérative d'une organisation
précise de l'appareil uro-génital, de notre
tube digestif ou de notre colonne vertébrale, puisque
les mêmes gènes officient dans toutes ces
structures (pourquoi une
nécessité et pourquoi pas une
conséquence ?). Il est donc
vraisemblablement vain de disserter sur la valeur adaptative
de la pentadactylie. Cette caractéristique,
très répandue chez les tétrapodes,
n'est peut-être que le sous-produit d'un plan
d'organisation global qui n'a que faire du nombre de doigts.
Cette approche théorique, qui s'appuie sur les
résultats de la génétique du
développement de ces dernières années,
n'est pas facilement intégrable dans une vue
strictement néodarvinienne de l'évolution. En
effet, cette dernière voudrait que le tout soit
l'ensemble de parties relativement indépendantes,
ayant des potentiels évolutifs propres liés
à des valeurs adaptatives locales. Alors que cette
vue gradualiste semble être la règle chez les
organismes peu complexes, tels que les bactéries, il
est probable que le problème se pose en termes
différents chez les eucaryotes supérieurs : la
marge de manoeuvre évolutive de telles parties (par
exemple la main) est alors conditionnée par leur
appartenance au tout. Ceci amène à repenser le
poids respectif des notions de variation et de
sélection. Bien qu'il ne soit évidemment pas
question de remettre en cause ces deux aspects fondamentaux
de la théorie de l'évolution, et donc de son
côté aléatoire et non
déterminé, il est vraisemblable que la
quantité de variations possibles n'est pas
illimitée et que l'interdépendance
génétique des systèmes ne permet
à l'organisme de ne produire qu'un nombre restreint
d'innovations morphologiques.(On
ne peut pas ici se dispenser de citer d'autres
théories évolutives qui sont basées non
pas sur un déterminisme aveugle, appelé hasard
par le néodarwinisme, mais sur un déterminisme
biologique, qui prend appui sur le résultat actuel
sans cesse renouvelé au cours du développement
embryonnaire et que l'on qualifie de développement
orienté).
Les mêmes gènes qui nous apprennent
comment la main se développe nous
révèlent donc également l'origine
phylogénétique de nos doigts et nous
renseignent sur l'étiologie et la pathogenèse
de syndromes génétiques humains affectant la
digitation. Ceci démontre bien que la biologie du
développement, la génétique
moléculaire, l'évolution et la
génétique médicale ne sont que des
aspects différents d'une même thématique
générale, et que seule une approche globale
faisant appel à toutes ces disciplines nous conduira
vers une compréhension satisfaisante de ces
phénomènes. En ce qui concerne nos doigts, une
approche combinée similaire d'autres syndromes
humains impliquant d'autres « gènes des doigts
» permettra sans doute, dans un avenir proche, de poser
les bases d'une vraie génétique
moléculaire de la digitation.»
(C'est comme cela que je
rêve de travailler mais je me laisse parfois
entraîner à critiquer plus qu'à
construire, ce que je regrette: la génétique
du développement devrait pouvoir s'intégrer
à une vision biologique et vitaliste mais c'est un
vaste chantier. A ce propos, si je partage l'optimisme de
Michel Morange
(L'importance
croissante de la biologie cellulaire, Pour la Science
Dossier Les sociétés cellulaires, Hors
Sértie Avril 1998, p
4-5), je crois cependant que le
réductionnisme mécaniciste liée au
développement de la biologie moléculaire est
encore tout à fait dominant, pour ce que je peux en
voir en tant qu'enseignant du secondaire).
|
|
La génétique du développement
de la mouche, Pierre Spierer et Michel
Goldschmidt-Clermont, La Recherche, 165, avril 1985,
p 452-461
Un article très clair qui
permet de retrouver tous les postulats, souvent
cachés aujourd'hui:
|
« La question que se posent maintenant les
embryologistes est de comprendre la nature de ce programme
[de développement] : où est-il
enregistré et comment ?»
« Comment les cellules savent-elles qu'elles doivent se
différencier en tissu d'aile plutôt qu'en tissu
de balancier, et s'organiser en aile plutôt qu'en
balancier ? On peut supposer qu'elles réalisent tel
ou tel destin d'après la position qu'elles occupent
dans l'embryon. ... Donc, les cellules doivent, d'une
manière ou d'une autre, connaître leur position
dans l'embryon, et d'après cette information
réaliser leur propre activité
métabolique et réaliser telle ou telle
architecture avec leurs voisines. De manière
générale, toute cellule réalise telle
ou telle activité métabolique sous la
direction de son patrimoine génétique contenu
dans ses chromosomes.(...) Mais dans la mesure où une
cellule devient une cellule d'aile plutôt qu'une
cellule de balancier et qu'elle réalise donc une
activité métabolique particulière
plutôt qu'une autre, c'est qu'elle exécute
certaines directives contenues dans le patrimoine
génétique plutôt que d'autres. Pour
prendre une image à l'informatique, on peut se
représenter le patrimoiner génétique
comme un programme, c'est-à-dire un ensemble
d'instructions. Toutes les cellules possèdent la
totalité du programme, mais on fonction de leur
position, elles n'exécutent que certaines
instructions. Nous arrivons donc à la
conception selon laquelle un programme de
développement de l'organisme est inscrit dans le
patrimoine génétique de cet
organisme.» Plus
de 25 ans plus tard, cette conception du
développement est passée dans les
médias, et est en cours d'enseignement dans le
secondaire par la plupart des enseignants
(ceux qui se
conforment aux manuels et, d'une certaine façon, au
programme, ou plus précisément aux indications
des GTD concernant le contenu de ce programme, les
particpiants aux GTD pouvant changer et ayant effectivement
changé entre la conception du programme et son
application...). Les nouvelles
conceptions, venant des embryologistes, comme celle de R.
Chandebois, n'ayant actuellement que peu accès aux
média.
Je renvoie à l'article très complet
pour la suite de la présentation des mutations
homéotiques, des gènes sélecteurs, de
la marche sur le chromosome (technique de génie
génétique ayant permis l'isolement de l'ADN
correspondant aux gènes du complexe
bithorax)...
|
|
Le remplacement des gènes, Mario
Capecchi, Pour la Science, 199, mai 1994
Les généticiens
créent des souris dont ils modifient les
gènes. L'étude des organismes ainsi
modifiés bouleverse la biologie animale.
|
Voici quelques réponses à partir de
l'article cité:
Si l'obtention d'organismes mutés par
exposition à des substances mutagènes qui
endommagent l'ADN est relativement facile pour des
unicellulaires, des problèmes insurmontables
apparaissent avec les animaux:
* le premier est la taille de l'animal et la
durée d'une génération: obtenir
une culture d'un milliard d'individus prend quelques jours
avec une bactérie qui se reproduit toutes les 20 min
et occupe un volume de quelques centimètres cubes
(une boîte de pétri), obtenir une population
identique prend quelques semaines avec un unicellulaire
eucaryote qui se reproduit toutes les heures et occupe un
volume de quelques litres, alors que l'élevage d'un
milliard de souris prend environ une année et occupe
une surface d'un hectare, ce qui est techniquement possible,
mais financièrement très coûteux.
L'élevage d'un milliard de drosophiles est aussi un
défi technique, même s'il est
réalisable. Si l'on utilise de petites plantes (comme
l'arabette des laboratoires... Arabidopsis thaliana),
on peut par contre obtenir une population aussi nombreuse,
dans un délai, un volume et pour un coût
raisonnables étant donné le grand nombre de
graines portées par un seul pied.
* le second argument est la taille du génome:
une bactérie contiendrait 3.000 gènes, la
drosophile plus de 20.000 et la souris plus de 300.0000,
d'après l'auteur de l'article. Ce qui empêche
l'exploration systématique de tous les gènes
(avec une banque proposant un mutant pour chaque
gène) et l'identification de tous les gènes
impliqués dans une mutation donnée. Cet
argument est surprenant car de très nombreuses
sources affirment que la taille du génome n'augmente
pas avec la complexité des organismes (en fait, il ne
s'agit pas de comparer la taille du génome d'une
bactérie avec celle de l'homme, ce qui n'apporte pas
grand chose de précis, mais de regarder les
différences entre des organismes appartenant à
des embranchements plus ou moins proches: annelides et
arthropodes, poissons et reptiles..., ce qui permet
d'affirmer que, en termes de paires de bases, il n'y a pas
de relation directe entre la taille du génome et la
complexité des organismes) mais, et ceci est bien
sûr sujet à discussion, la taille du
génome n'augmente pas non plus en terme de
gènes fonctionnels: la souris est l'homme
possèderaient environ 25 à 50.000 gènes
fonctionnels tous les deux... et la drosophile
possèderait entre 10 et 20.000 gènes
fonctionnels (voir histoire de
la génétique). Par contre il est certain
qu'une mutation, et surtout une mutation affectant un
gène essentiel dans le développement, touche
de nombreuses fonctions qui se développent dans le
temps et que la plupart des mutants homozygotes pour ce
genre de gènes ne survivent pas aux premières
étapes du développement embryonnaire.
Bref, les mutants de souris présentés, par
exemple pour les gènes Hox, sont des
mutants dirigés c'est-à-dire obtenus
par mutation dirigée, qui est en fait une
technique de transgénèse. La technique
extrêmement sophistiquée (... coûteuse)
et longue (6 ans d'effort d'une équipe de chercheurs
pour obtenir des résultats probants) consiste
à insérer un gène dans une cellule
souche (ce qui est un exploit technique: une cellule sur un
million environ incorpore le gène au bon endroit) qui
est insérée à son tour dans un embryon
au stade blastocyste et qui intégre parfois (le taux
d'échec est ici aussi très important) cette
cellule à son développement (il faut pour cela
disposer de marqueurs, habituellement ce sont des
gènes affectant la couleur du pelage comme le
gène agouti (pelage de couleur brune) qui sont
ajoutés) et donne ainsi des individus
chimères dont certains possèdent des
gamètes transgéniques pouvant être
à l'origine d'individus transgéniques
possèdant un ou deux exemplaires du gène
inséré (là encore une sélection
est indispensable). (voir figure ci-dessous)
Dans le cas du gène Hoxa 3 par exemple, les
souris obtenus par cette technique (croisement de deux
souches hétérozygotes pour le gène
Hoxa3 qui survivent sans déformation) meurent
à la naissance principalement à cause de la
malformation de leur appareil cardiovasculaire. Des coupes
histologiques de l'embryon permettent de déceler de
nombreuses anomalies au niveau du thymus, des glandes
thyroïde et parathyroïdes, les os et cartilages de
la région inférieure de la tête ainsi
que des tissus conjonctifs, muscles et cartilages de la
gorge. Ces anomalies sont apparemment localisées
dans une bande correspondant à la base de la
tête, au cou et à la première partie du
thorax de l'embryon (voir dessins et photos dans
l'article).(une question naïve: ?
a-t-on réellement recherché
d'éventuelles anomalies dans des coupes
sériées de tout l'embryon ? question qui en
appelle une autre: une présence d'anomalie est-elle
pas la preuve d'absence de régulation plutôt
que celle d'un dysfonctionnement ? la région
où se développe les anomalies dépendant
alors de la progression autonome et non d'une information de
position)
Une maladie humaine, classée parmi les maladies
génétiques, semble présenter des
symptômes voisins: c'est le syndrome de Di George,
mais une analyse chromosomique a montré que le
gène Hoxa3 équivalent chez l'homme de
celui de la souris, n'était pas muté chez les
(?) malades où on l'a recherché.
|
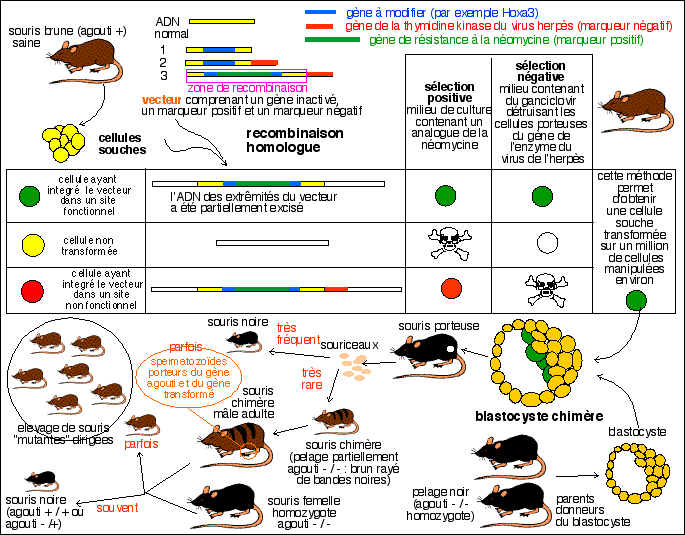
D'après Pour la Science, 199, mai 1994,
p 58-59 et 60-61, très modifié
Comment obtenir des mutants dirigés chez la souris ?
Une transgenèse très longue, complexe,
coûteuse et aléatoire.
|
De la mouche à l'homme, un même
supergène pour l'œil, W.
J. Gehring, La Recherche, octobre 1995, 280, pp
58-64
|
Cet article a été
pris comme point de référence par de nombreux
collègues enseignants et un "résumé"
non critique en a été fait sur le site de
l'inrp: http:///www.inrp.fr/Acces/biotic/develop/controle/html/histgen.htm
avec d'ailleurs une erreur de référence de
l'article (octobre 1995 et non février 1995). Je
souhaite en faire un commentaire critique.
(p 58) «l'œil possède un plan
génétique de construction identique chez les
insectes et les mammifères, bien que l'œil
composé des insectes soit bâti de façon
totalement différente de l'œil
mammalien.» Cette phrase peut
aisément être retournée:
étant donné que
l'œil composé des insectes
est
bâti de façon totalement différente de
l'œil mammalien (on
pourrait dire des vertébrés) et comme il met
en jeu des mécanismes génétiques
identiques chez les insectes et les
mammifères, cela
tend à prouver que l'œil ne possède
pas de plan génétique de
construction. La
présence de gènes identiques ou similaires,
ainsi que l'ordre de leur expression et les
mécanismes de leur contrôle par des
molécules voisines sont au contraire un argument
contre la notion de programme de développement. Les
similitudes moléculaires et physiologiques,
étant donné le résultat final si
différent, embryologiquement,
histologiquement, anatomiquement tendent plutôt
à situer l'origine de la différence et donc la
causalité du développement autre part que dans
les mécanismes invoqués. Si deux gènes
similaires, activés à des moments
différents chez deux individus appartenant à
des groupes très éloignés donnent des
structures très diverses, c'est donc qu'ils ne
portent en eux que peu de spécificité. Cette
remarque a été faite pour de nombreux
gènes de développement (voir ci-dessous),
notamment des gènes homéotiques, qui sont
activés pour donner des structures très
différentes.
(encadré p 63) «Certains gènes
régulateurs [dont les produits contrôlent
la transcription], les gènes
maîtres (ou gènes de contrôle)
sont situés au sommet d'un édifice
génétique d'où ils régulent un
ensemble de gènes secondaires
qui, eux-mêmes, influencent l'activité d'autres
gènes cibles, d'un niveau
inférieur dans la hiérarchie. De cet
édifice naissent des signaux chimiques qui sont
transmis du noyau cellulaire au cytoplasme et de cellule
à cellule. Finalement des gènes de structurs
activés par ces signaux s'expriment et codent des
blocs de construction, c'est-à-dire des
protéines à partir desquelles les structures
et organes de l'organisme sont mis en place.»
Cette vue d'une hiérarchisation
de l'information génétique ne reste pour
l'instant qu'un rêve... de généticien:
il est prouvé que l'information
génétique va bien de l'ADN aux ARN puis aux
protéines mais peut aussi aller des ARN à
l'ADN. Par contre l'information cytoplasmique ou
extracellulaire peut modifier l'information
génétique
(sous forme de
protéine qui reste semble-t-il le passage
obligé pour modifier l'expression
génétique, même pour des hormones comme
les hormones stéroïdes qui se fixent sur des
récepteurs protéiques qui agissent comme
facteurs de transcription).
Présenter l'information du vivant comme
gouvernée par des gènes fonctionnellement
emboîtés est en fait réducteur et il me
semble préférable de dire que l'information
génétique est un outil au service de la
cellule qui la module en fonction de sa mémoire
cytoplasmique (son profil métabolique) et des
données qu'elle reçoit venant des autres
cellules.
une réponse de Rosine
Chandebois, professeur à
l'université de Provence, dans un courrier à
La Recherche du mois de mai à la
suite de l'article de W.J. Gehring :
« Après la parution de l'article de W.J. Gehring
dans le n°280 (Octobre 95), il me paraît utile de
rappeler que le développement des mutants
eyeless (e) de l'Axolotl a été
décrit et analysé notamment par Cuny et
Malacinski (J. Embryol. exp. Morph. 96 1986).
« Chez les Axolotls homozygotes pour le gène
e, le développement de la rétine est
arrêté au stade de la jeune vésicule
optique (stade 1), bien que des divisions sporadiques
s'observent plus tard. A l'éclosion, la rétine
neurale est représentée par une masse
irrégulière de cellules. La rétine
pigmentaire est, elle, représentéé par
quelques cellules à pigment. De petits cristallins de
forme anormale peuvent aussi se constituer. Les rudiments de
la rétine et des cristallins se
désintègrent pendant la vie larvaire. Chez les
hétérozygotes pour les deux gènes
e et r (insuffisance rénale,
léthal, récessio les yeux se
développent jusqu'au stade 16 ».
L'expérimentation (association in vitro de tissus de
génotypes e-e et sauvage et application
d'un extrait de cornée de boeuf qui stimule le
développement de la rétine normale) a
montré que la mutation crée une insuffisance.
Cette insuffisance peut être liée à un
défaut des desmosomes qui relâcherait les
contacts cellulaires. Elle est localisée à la
partie de la plaque neurale qui recouvre les territoires
présomptifs des vésicules optiques et de
l'hypothalamus, tous les autres tissus impliqués dans
la formation de l'oeil présentant des
capacités histogénétiques et
morphogénétiques normales. De taille
très réduite, la vésicule optique est
cependant capable d'induire un cristallin dans
l'épiderme, mais les inductions ultérieures
(comée, cartilage scléraux) font
défaut. En conséquence, l'évolution est
bloquée. Enfin, faute d'innervation
rétinienne, le tectum opticum demeure rudimentaire.
La déficience de l'hypothalarnus se manifeste par
l'insuffisance de deux hormones hypophysaires d'où la
pléiotropie (stérilité des gonades,
pigmentation anormale).
La mutation eyeless est donc ici clairement
associée à une défiscience de
l'ensemble de l'hypothalamus présomptif qui a son
tour provoque la stérilité des gonades et des
anomalies de la pigmentation de la peau. Ce cas illustre
bien le fait qu'un dysfonctionnement tissulaire n'est pas
forcément du à des gènes que le tissu
doit maintenir constamment en activité. Autrement
dit, un tissu ne fonctionne pas nécessairement de
manière normale dans un organisme si les gènes
dont il lui faut entretenir la transcription sont normaux.
Ceci parceque les cellules ne sont pas sous le
contrôle des gènes mais les utilisent en
fonction des informations communiquées par leurs
voisines et par la qualité du cytoplasme
hérité de leur ascendance.
(RC, notes 50 et 56, p 86, texte
très légèrement
modifié).
La formation des yeux sur les antennes et les pattes
d'une drosophile est un phénomène de
même ordre que celle d'une patte supplémentaire
dans le flanc d'un arnphibien. Les mécanismes de
l'émergence d'un bourgeon de membre sont bien connus.
La détermination de son territoire présomptif
est liée à celle d'un mésenchyme
particulier, issu des lames latérales.
L'amplification de la synthèse de
protéoglycans qui a lieu se solde par
l'émergence d'ilots de précartilage à
l'origine des pièces du squelette (Ede et Flint, 3rd
Symp. Froc. Soc. Dev. Biol. 1977). Sa croissance apicale,
qui impose l'agencement particulier des îlots, est
entrenue par la calotte qui se forme à son contact
dans l'épiderme. La poussée d'un membre
supplémentaire a été obtenue
après implantation dans le flanc de l'embryon,
à un stade critique du développement, d'une
placode olfactive, d'une vésicule optique ou d'un
bloc de celloidine (Balinsky, 1933).
D'après Stephen et al (J. Embryol.exp. Morph. 59,
1980), les lames latérales, même au niveau des
flancs, élaborent du collagène et des
protéoglycans identiques à ceux du bourgeon de
membre, mais elles ne peuvent en acquérir les
propriétés qu'après dissociation des
cellules. Ce processus n'est pas un cas particulier.
Dès 1952, Holtzer (J.exp. Zool.121) avait posé
comme principe général que les produits
spécifiques d'un tissu sont élaborés
très tôt dans l'embryon, même en dehors
de son territoire présomptif. Cette synthèse
est amplifiée localement au moment de la
détermination du tissu mais peut continuer ailleurs,
à faible régime dans divers tissus,
jusqu'à un stade plus ou moins avancé du
développement (éventuellement chez l'adulte).
Cela a été récemment confirmé
pour la neuralisation de l'ectoderme (Sharp et al.
development 107, 1989). Dans les tissus où subsistent
ces activités résiduelles, les cellules
conservent la faculté de prendre l'identité
tissulaire correspondante (transdifférenciation) si
une modification de leur cohésion leur est
imposée.
Pour des raisons essentiellement techniques, des
recherches analogues n'ont pas été
réalisées sur les embryons de drosophile. Rien
donc, pour l'instant, ne s'oppose à ce qu'on
interprète l'expérience de Gehring comme celle
de Balinsky. Un certain nombre d'arguments plaident
d'ailleurs en faveur de cette extrapolation. A l'origine de
cette homoeose, on trouve une transdifférenciation
des téguments en cellules visuelles. Or la
transdifférenciation inverse peut être
provoquée par divers facteurs non spécifiques.
C'est par exemple le cas pour les homœoses qui
n'impliquent pas de changements d'identités
tissulaires (Hadom in Locke : Major Problems in dev. Biol.
N.Y. Acad Press, 1966). Par ailleurs, la répartition
inégale des yeux atrophiques évoque bien une
transdifférenciation. Ce phénomène
n'affecte jamais la totalité d'un morceau de tissu
mis en culture ou reconstitué par la descendance
d'une cellule unique (Okada et al. Dev. Biol. 45, 1975). Les
cellules transdifférenciées se condensent
localement et s'organisent parfois de manière frustre
(par exemple les corps lentoïdes de la rétine
neurale). La composition du milieu ne la provoque pas, elle
peut tout au plus la favoriser (Pritchard et al. J. Embryol.
exp. Morph. 48, 1978). »
|
|
Conclusion-résumé:
Un gène
architecte est un
gène mis en œuvre dans des étapes de
prolifération cellulaire dans toutes les populations
engagées dans des progressions autonomes.
Le point essentiel que cet article met en évidence
est que les gènes architectes
représentent une multitude de fonctions mises
en œuvre dans de très nombreuses populations
aux destinées différentes.
L'information de position est un concept qui n'est
pas nécessaire d'invoquer si l'on considère le
développement autonome et les interactions
successives entre populations cellulaires (notamment les
réajustements). Une cellule appartenant
à une population engagée dans une progression
autonome (on dit
«déterminée»)
développe un certain métabolisme (on dit
qu'elle a un «profil métabolique»
défini) et garde en mémoire, dans son
cytoplasme et de par les métabolismes qu'elle
développe, une trace de son histoire. A partir
d'un certain seuil (de rendement des gènes ou
d'un type de métabolisme particulier) son engagement
dans un type histologique spécifique devient, dans
des conditions normales, irréversible. Les
cellules engagées dans ce processus sont dites en
cours de différenciation (le terme de
«détermination» étant à
réserver au démarrage de la progression
autonome pour une population, ce qui se traduit par une
certaine spécificité des cellules
embryonnaires que l'on peut mettre en évidence par
des greffes en embryologie expérimentale). Il reste
à expliquer comment les gènes
sélecteurs homéotiques des
généticiens sont activés de telle
façon qu'ils semblent déterminer
l'organisation des premiers segments de l'embryon.
|
retour plan
|
exemple 2:
l'étude du
développement embryonnaire et post-embryonnaire de la
drosophile,modèle de prédilection des
généticiens :
Drosophila melanogaster,
Arthropode, antennate, Insecte, holométabole,
Diptère
|
|
l'ovogénèse chez la drosophile
(schémas issus de La
reproduction des invertébrés, Cassier et al.,
Masson, 1997, modifiés)
|
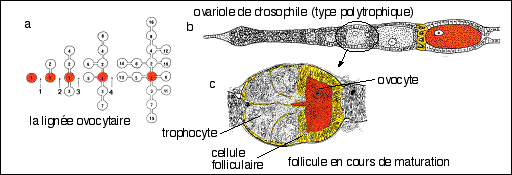
|
|
La structure allongée contenant les ovogonies et
dans laquelle se déroule l'ovogénèse
est une ovariole. Les ovaires sont constitués d'une
ou de plusieurs ovarioles (je n'ai pas trouvé le
nombre pour la drosophile). Les premières
étapes de l'ovogénèse débutent
chez la larve puis se continuent chez la nymphe (pupe). Les
ovocytes sont issus d'une ovogonie unique (2n) qui subit une
série de mitoses incomplètes car les cellules
filles restent unies par des ponts cytoplasmiques (fig a);
on parle d'œuf méroïstique (du grec
méro = couper). Une seule cellule fille,
normalement celle qui possède le plus de liaisons
cytoplasmiques avec les autres (et qui hérite du
centriole), évolue en ovocyte I en démarrant
une méiose bloquée rapidement au stade
diplotène. Les autres cellules sont appelées
des trophocytes. Les cellules germinales sont
entourées de cellules folliculaires (fig. b et c) par
lesquelles transitent les nombreuses substances
nécessaires à la fabrication des
réserves importantes de l'ovocyte, qui sont
majoritairement fabriquées dans le corps gras de
l'insecte. Les cellules folliculaires participent activement
à l'élaboration des enveloppes protectrices de
l'œeuf (chorion) qui sont une caractéristique
des œufs libérés en milieu aérien.
L'œuf est centrolécithe, avec un vitellus
abondant, le noyau étant au milieu de l'œuf.
|
|
L'ovulation se fait par expulsion de l'ovocyte I pourvu
de ses enveloppes suite à l'accouplement. Les
spermatozoïdes déposés dans le vagin par
le mâle pénètrent à travers le
chorion grâce à des micropyles et
déclenchent la fin de la méiose avec expulsion
des 2 globules polaires.
|
|
Le développement embryonnaire:
commence à la fécondation et
s'arrête à l'éclosion de la larve
(asticot) .... le lendemain. En effet, le
développement embryonnaire ne dure qu'un jour mais il
est pourtant d'une complexité extraordinaire.
|
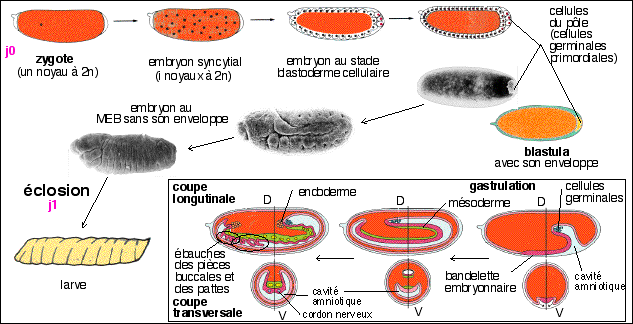
Schémas et photos d'après Belin,
2nde, Biologie moléculaire de la cellule et E.U. très
modifiés
|
Le zygote commence son développement dès la
fécondation mais les premières divisions du
noyau (caryodiérèse) ne sont pas suivies par
des divisions cytoplasmiques, peut-être en raison de
la charge très importante en vitellus et de la
position centrale du premier noyau. Si l'on désire
comparer avec le développement des
vertébrés comme celui de la grenouille, les
premières phases finissent par aboutir à une
segmentation de l'embryon en cellules disposées
à la périphérie d'une masse
cytoplasmique riche en vitellus et surmonté à
un pôle par des cellule germinales. On parle alors de
segmentation superficielle. La "cellularisation" de
la masse cytoplasmique commence au stade 256 noyaux (28
) par les cellules germinales et se termine avec
environ 6.000 noyaux. Les cellules externes forment le
blastoderme et les cellules internes, beaucoup moins
nombreuses, les vitellophages, chargées de
"digérer" le vitellus. Tout le développement
embryonnaire se fait à l'intérieur des
enveloppes (chorion, séreuse) et il est à
noter que l'on ne peut pas rompre ces
enveloppes sans stopper définitivement le
développement (ce qui n'empêche
cependant pas quelques opérations de microchirurgie,
voir plus bas, mais qui constitue un handicap majeur pour
une étude d'embryologie expérimentale
classique comme pour les oursins ou les amphibiens). On
parle cependant de stade blastula. La gastrulation
est assez atypique: il se forme d'abord, sur la face
ventrale , une bandelette germinative (ou
embryonnaire) qui représente la première
ébauche de l'embryon. Cette bandelette va se creuser
d'un sillon médian longitudinal, le sillon
gastrulaire, qui se referme ensuite et forme un tube
individualisant un endomésoderme. Dans le même
temps, les bords du blastoderme se soulèvent autour
de l'embryon et forment des replis qui vont se rejoindre,
formant une cavité amniotique, milieu liquide dans
lequel «baignera» l'embryon (c'est un
caractère que l'on rattache souvent à un
développement protégé en milieu
aérien). Dans l'ectoderme de l'embryon, des
neuroblastes vont apparaître et former deux cordons
nerveux longitudinaux à l'origine de la chaîne
nerveuse ventrale. L'endoderme se différencie pour
former l'intestin. Le mésoderme se développe
avec l'apparition d'une métamérisation
et la formation de somites qui fusionneront pour former
l'hémocèle. La métamérie
est la propriété des animaux
triblastiques (formés de trois feuillets
embryonnaires) coelomates (dont le mésoderme,
feuillet intermédiaire se creuse de cavités
cœlomiques formant un cœlome) et
composée de segments embryonnaires anatomiquement et
physiologiquement répétés
(métamères). Cette
métamérisation est progressive: elle
apparaît soit au niveau de la tête et
s'étend vers l'abdomen, soit au niveau du segment
prothoracique et se propage dans les deux sens. Des
appendices métamérisés se forment, mais
ils ne persisteront que sur une partie des
métamères. La métamérie
embryonnaire ne subsiste que très partiellement chez
la larve et encore plus partiellement chez l'imago.
Remarque:
les triblastiques cœlomates comprennent les
prostomiens (dont le blastopore, orifice de la
blastula donne la bouche: Annélides, Lophophoriens,
Mollusques et Arthropodes) et les
deutérostomiens (dont le blastopore donne
l'anus: Chætognathes, Echinodermes,
Stomocordés, Pogonophores, Urocordés,
Céphalocordés et
Vertébrés).
|
|
Comme pour l'embryon d'amphibien il a été
établie une carte des territoire
présomptifs de l'embryon de drosophile au stade
blastoderme. Mais cette carte n'a pas la même
valeur dans les deux cas: pour la drosophile elle n'est pas
soutenue par des expériences d'embryologie
expérimentale CAR je repète encore que L'ON NE
PEUT PAS OUVRIR L'ENVELOPPE SANS TUER L'EMBRYON. La valeur
des territoires présomptifs n'est que l'indication
que, si l'on suit le devenir des populations sans perturber
le développement, les populations du blastoderme se
retrouvent à telle ou telle position, toujours
identique dans la larve. Mais il n'y a pas de DETERMINATION.
On ne suit que la progression normale du
développement, comme on peut le faire à l'aide
de marques colorées sur une blastula puis une
gastrula d'amphibien.
a - Les gènes de polarité de
l'œuf
Sur cette carte des populations cellulaires(en fait des
progressions autonomes) on superpose une carte des anomalies
de développement engendrées par des mutations
de gènes qui ont été nommés:
gènes de polarité de l'œuf. Ces
gènes sont appellés des gènes
à effet maternel car ce sont des gènes de
l'ovocyte (seuls "activés" dans le zygote par
l'intermédiaire de leurs produits: les ARNm maternels
; les gènes paternels n'étant activés
qu'au stade mi-blastula (?) ... voir plus haut dans cette
page). Pour obtenir un embryon anormal c'est donc une
femelle homozygote mutée qu'il faut obtenir, le
génotype du spermatozoïde n'intervenant pas ici.
Ces gènes ont été identifiés
lors d'une recherche exhaustive des mutants dans lesquels la
polarité de l'embryon est perturbée (travaux
de C. Nüsslein-Volhard, 1986, 1992). On les classe en
un groupe de 12 gènes de polarité
dorso-ventrale (dont le phénotype mutant provoque
une absence de structures ventrales), 4 gènes de
polarité antérieure (par exemple
bicoïd), 11 gènes de polarité
postérieure (par exemple nanos) et 6
gènes du groupe dit "des
extrêmités"(par exemple torso). Les
produits de ces gènes ont été
activement étudiés. Les protéines de
régulation peuvent être
découpées, généralement en
régions fonctionnelles appelées domaines. Un
de ces domaines a la propriété de se lier
à l'ADN dans les régions de contrôle de
l'activité des gènes cibles. Plusieurs
structures tridimensionnelles de domaines de liaison ont
été mises en évidence. Celles-ci se
retrouvent dans de nombreux gènes impliqués
dans le développement embryonnaire de nombreuses
espèces. Un de ces domaines s'appelle
l'homéodomaine, car il a d'abord
été décelé dans les
protéines codées par les gènes
homéotiques. La chaîne d'acides aminés
de l'homéodomaine comporte quatre hélices,
dont une assure la reconnaissance de l'ADN cible. La
protéine du gène bicoïd contient un
tel homéodomaine. La protéine dorsal
contient un autre type de domaine de liaison à l'ADN.
Il est lui-même présent dans plusieurs
protéines de régulation connues chez les
vertébrés. Certains de ces gènes,
normalement employés lors du développement
embryonnaire, sont d'ailleurs incriminés dans la
génération de tumeurs après mutation ou
réexpression anormale chez l'adulte. Les ARNm dorsal
(détectés par hybridation in situ) et la
protéine pour laquelle ils codent
(détectée par des anticorps) sont
répartis de façon homogène dans le
cytoplasme du zygote. Mais au stade blastoderme, au
début des caryodièrèses, la
protéine se concentre dans les noyaux ventraux du
blastoderme. On suppose alors qu'elle inactive ou active
selon sa concentration les gènes nucléaires
à effet maternel des cellules du blastoderme codant
pour les autres protéines impliqués dans la
polarité dorso-ventrale comme la protéine DPP
par exemple (codée par le gène dpp
décapentaplégique) dont la concentration
présente un gradient dorso-ventral inverse à
celui de la protéine codée par le gène
dorsal.
Le système est à la fois trop complexe, du
fait du degré de sophistication des méthodes
de biologie moléculaire, et trop simpliste dans ses
explications pour que je puisse avoir accès à
l'ensemble des informations et que je puisse les comprendre
et les présenter ici (tout revient toujours à
une activation séquentielle de gènes du
développement et donc d'un programme
génétique de développement): il y a un
réel fossé entre une technicité de la
recherche de plus en plus poussée et une
réflexion naturaliste. Il y a même une
séparation d'avec la méthode
expérimentale, car on à l'impression à
la lecture des articles de vulgarisation qu'ils mettent
à notre disposition que souvent les chercheurs ne
cherchent pas à prouver une hypothèse mais
à développer le paradigme dominant, dans le
but d'une reconnaissance sociale et financière, ce
qui est œuvre de technique.
Une technique de microchirurgie (H.G.
Frohnhöfer, R. Lehman et C. Nüsslein-Volhard,
1986) permet d'extraire une partie du cytoplasme
antérieure du zygote, par rupture très
localisée de l'enveloppe, puis d'injecter par une
micropipette un peut de cytoplasme postérieur venant
d'un zygote donneur par cet orifice. On obtient le
lendemain, si l'embryon se développe, une larve dite
"double postérieure" qui présente une absence
de tête. Mais je ne connais pas l'anatomie de cette
larve et elle n'est probablement pas viable. Les
généticiens du développement
interprètent cette malformation provoquée par
la présence de morphogènes spécifiques
dans les extrêmités du zygote.

Expérience de microchirurgie sur le zygote de
drosophile (d'après
Biologie moléculaire de la cellule, 21-58)
Voir aussi la fig 6 p 47 dans l'article :
De l'œuf à
l'embryon, Christiane Nüsslein-Volhard, Pour
la Science, Dossier "Les sociétés
cellulaires", Hors Série, avril 1998
où l'on obtient un résultat symétrique
avec injection d'ARNm bicoïd dans la partie
postérieure du zygote.
Dans le cadre de leur hypothèse, ils ont
réalisé cette même expérience sur
des zygotes possédant la mutation bicoïd
c'est-à-dire qui conduisent normalement à
des larves sans tête et sans structures thoraciques
mais dont les structures abdominales se développent
normalement. Si l'on injecte le cytoplasme de
l'extrêmité antérieure d'un zygote non
muté à l'extrêmité
antérieure du zygote issu d'une mère
homozygote bicoïd -/-, l'embryon obtenu semble
complet. Cela met sans aucun doute en évidence le
rôle essentiel des déterminants maternels
de type ARNm dans le cytoplasme du zygote (voir plus
haut, pour les amphibiens).
Dans le cadre de la même hypothèse on a, par
des techniques d'hybridation in situ, localisé
les ARNm bicoïd que l'on a suivi depuis leur
synthèse dans les cellules nourricières
(trophocytes: voir schéma d'un follicule dans une
ovariole de drosophile ci-dessus) jusqu'à leur
stockage dans le cytoplasme de l'ovocyte. Le gradient de
concentration de la protéine Bicoïd, dont la
synthèse commence dès la ponte, est
orienté de façon décroissante depuis
l'extrêmité antérieure du zygote
jusqu'à l'extrêmité postérieure.
Si l'on insère dans le génome maternel
plusieurs copies de l'ADN bicoïd , on obtient
des embryons normaux malgré une augmentation forte du
gradient corrélée au nombre de copies du
gène bicoïd et l'apparition d'une
métamérisation décalée vers le
pôle postérieur. C'est un cas important de
régulation car, malgré ce
décalage au tout début de
l'organogenèse, les larves sont alors correctement
proportionnées. Les auteurs des expériences
les interprétent comme une confirmation du rôle
de la concentration locale des protéines Bicoïd
dans la mise en place des métamères
antérieurs. Mais ils y associent le concept
d'information de position matérialisé ici par
un gradient de substance morphogène. Ce qui n'est pas
forcément nécessaire. L'induction
démarrant au pôle antérieur
détermine naturellement un gradient par une
progression de proche en proche depuis le pôle
antérieur, de cellule à cellule. Ce type de
gradient (gradient d'induction) est une conséquence
directe de la progression autonome d'une population dont la
détermination commence localement à la
périphérie de la population et progresse
ensuite de proche en proche.
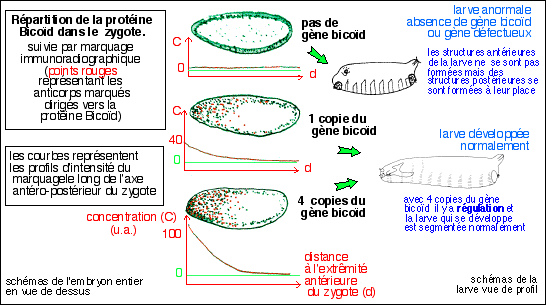
Gradient d'expression du gène bicoïd
(à effet maternel) dans le zygote de
drosophile (pour zéro, une et quatre copies du
gène)
visualisé grâce à un marquage
radio-immunologique (anticorps marqués
radioactivement dirigés vers la protèine
Bicoïd)
et larve résultant du développement
(d'après Biologie
moléculaire de la cellule, fig 21-59 et 21-53,
très modifiées).
Remarque:
une brève récente de La Recherche
revêt à mon sens une importance
particulière (Emmanuel Farge: «Certains
gènes embryonnaires sont
mécano-sensibles», La Recherche,
369, novembre 2003, p 16-17 d'après E. Farge,
Current Biology, 13, 1365, 2003). Ce chercheur
a soumis la larve de drosophile à une
légère compression latérale et a
noté que l'expression des gènes du
système antéro-postérieur n'a pas
été modifiée mais par contre que celle
des gènes du système dorso-ventral dont
le gène twist a été
modifiée. Le gène twist, normalement
exprimé dans les seules cellules ventrales, a
été exprimé sur tout le pourtour de
l'embryon (comme c'est le cas pour certains mutants). De
même l'expression du gène twist est fortement
amplifiée dans les cellules du pôle
antérieur qui s'invaginent pour former le tube
gastrique antérieur.
Cette liaison, qui demande sans aucun doute à
être confirmée pour d'autres
expériences, ouvre la porte à un raisonnement
tout à fait original: les
contraintes mécaniques auxquelles sont soumises les
cellules au cours du développement du fait par
exemple des divisions cellulaires, du gonflement de couches
basales hydrophiles,..., peuvent
modifier l'expression de gènes. On a donc un
contrôle possible de l'expression du génome par
des stimuli externes (travail de relation). Le travail du
groupe de mécanique et génétique du
développement embryonnaire de l'unité de
physico-chimie de l'Institut Curie (UMR CNRS/IC) dont
dépend E. Farge est sans aucun doute prometteur.
b - des gènes de segmentation
(gap, pair-rule, polarité segmentaire et
sélecteurs homéotiques)
Un groupe d'environ 25 gènes de segmentation
a été caractérisé de la
même manière en contrôlant toutes les
anomalies de développement portant sur le nombre de
segments, sans modifier la polarité de l'œuf
(antéro-postérieure et dorso-ventrale). Ces
gènes appartiennent au génome propre du zygote
et sont activés à la fin de
l'organogenèse (on parle de gènes à
effet zygotique). Par exemple chez le mutant
Krüppel (muté au niveau d'un groupe d'au
moins trois gènes de régionalisation dit
gènes gap), il manque à la larve les 3
segments thoraciques et les 5 premiers segments abdominaux.
De même la mutation even-skipped (eve)
(correspondant à un groupe de huit gènes de
parité segmentaire ou pair-rule) provoque
l'absence de tous les parasegments pairs (les parasegments
sont une dénomination commode pour les
généticiens et correspondent aux segments
(métamères) décalés d'un
demi-segment vers l'extrémité
postérieure: les 4 segments céphaliques
correspondant aux parasegments 0, 1, 2 et la moitié
du 3; les trois segments thoraciques aux parsegments, 3
(pour la moitié), 4, 5 et 6 (pour la moitié)
et les 9 ou 10 segments abdominaux aux 8 et demi
parasegments restants). Enfin la mutation goosberry
par exemple (appartenant au groupe de 10 gènes de
polarité segmentaire) provoque la perte de la
moitié postérieure de chaque segment,
c'est-à-dire la moitié antérieure de
chaque parasegment. Toutes ces mutations conduisent à
des arrêts précoces dans le
développement et à la mort de
l'embryon.
Comme c'est la même protéine, par exemple la
protéine Eve (codée par le gène
even-skipped ou eve), qui est
synthétisée dans chaque segment, on cherche
à trouver l'information de position dans les
séquences régulatrices situées en amont
du gène eve. Le gène eve
présente une région régulatrice
très étendue (formée par l'ensemble des
séquences d'ADN gouvernant les facteurs de
transcription du gène et estimée à
environ 20.00 paires de bases - à rapprocher du
chiffre de 140.000.000 de paires de bases pour la
totalité du génome mais aussi de
l'unité de recombinaison qui est de 500.000 paires de
bases) au niveau de laquelle on pense qu'il existe des
unités de regulation spatiales des 7 bandes
d'expression du gène eve alignés comme
dans l'embryon en cours de segmentation. A l'appui de cette
théorie des expériences de déplacement
de certains fragments de la zone de régulation. Par
exemple la bande 2 est une bande sur laquelle on a
identifiée des sites de fixation des protéines
codées par les gènes de polarité de
l'œuf (comme le gène bicoïd dont la
protéine de régulation Bicoïd qui active
la transcription du gène eve en se fixant sur cette
zone de régulation ou le gène
Krüppel dont la protéine de
régulation inactive la transcription du gène
eve). Vous noterez par exemple sur la figure
ci-dessous qu'en absence de gène bicoïd
le deuxième segment d'expression du gène
eve est inactivé. On a déplacé
cette bande 2 (480 paires de bases) de la séquence de
régulation du gène eve et à l'a
insérée en amont d'une séquence
activatrice du gène de la ß-galactosidase,
lui-même transféré avec ses
séquences d'activation dans un génome
d'embryon de drosophile. Et effectivement on a
observé que ce gène de la
ß-galactosidase était exprimé au niveau
du deuxième segment d'expression du gène
eve. Ce que l'on interprète comme une
information de position contenue dans cette séquence
régulatrice de la bande 2. Ne pourrait-on pas
interpréter cette expérience comme une preuve
de l'universalité des séquences
régulatrices mais de la spécificité de
leur activation ? Dans la zone précise où
l'induction a lieu (notamment par la protéine
Bicoïd) le gène de la ß-galadosidase est
activé tout comme le gène eve puisqu'on
lui a adjoint la même séquence de
régulation. La séquence de régulation
est inefficace dans d'autres cellules parceque ce sont les
signaux inducteurs qui font défaut. Le travail de
fourmi réalisé par les
généticiens est colossal car il conduit
à isoler pour chaque site la cascade d'induction.
Comme la combinaison spécifique de différents
inducteurs a un endroit précis détermine en
quelque sorte la réponse d'une cellule (on parle de
régulation combinatoire), les
généticiens du développement s'appuient
habituellement sur l'hypothèse d'une information
de position: dans chaque noyau, en amont de chaque
gène, les séquences régulatrices
évaluent les concentrations en morphogènes
afin de déterminer la position spatiale de la
cellule. Si à l'opposé de cette
hypothèse on donne la maîtrise à la
cellule, au sein d'une population, et que l'on
considère que c'est elle qui répond aux
signaux inducteurs auxquels elle est soumise, avec sa part
d'autonomie liée à son métabolisme (on
parle plutôt alors de comportement social
élémentaire). Sa position n'est jamais
déterminée de façon absolue par des
coordonnées mais de façon relative par
rapport aux cellules de sa population et par rapport aux
populations voisines.
|
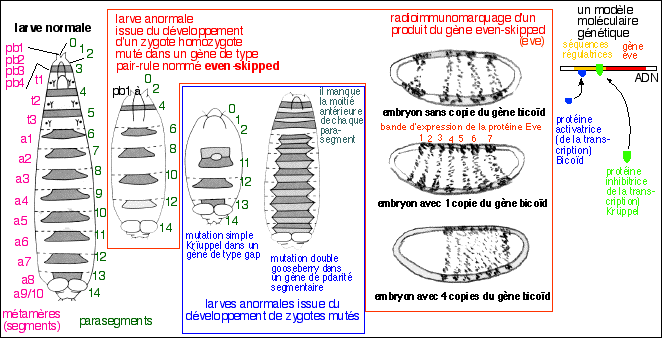
Segmentation anormale des larves issues de zygotes
mutés dans des gènes à effet zygotique du
groupe de segmentation (conduisant à un arrêt
précoce de développement)
et profil d'expression d'une protéine codée par un
gène du groupe pair rule (gène
even-skipped) chez un embryon issu du
développement d'un zygote comportant zéro, une ou
quatre copies du gène bicoïd à effet
maternel (d'après biologie
moléculaire de la cellule, 21-59 et 21-60, très
modifiées et p 426-429)
|
Ces expériences atteignent un niveau de
difficulté d'analyse très
élevé:
* la technique est indirecte (radioimmunomarquage) et donc
présente différente incertitudes et
approximations qui sont évidentes pour un chercheur
mais pas pour un élève - voir quelques
données sur les techniques immunologiques dans le
cours
d'immunologie de terminale)
* d'un côté on a des gènes
ovocytaires dont les ARNm sont suspectés avoir un
rôle déterminant dans l'orientation de l'axe
antéro-postérieur du zygote puis de la
blastula (gène bicoïd: voir la figure
au-dessus pour les conséquences au niveau de la
larve);
* de l'autre on a des gènes activés chez
l'embryon (gènes à effet zygotique) et
dont le dysfonctionnement (réalisé par
mutation) provoque des anomalies de segmentation
reproductibles; ces gènes codant la plupart du temps
pour des protéines régulatrices capables de se
fixer à l'ADN.
A mon sens postuler le rôle d'un gène dans
l'établissement d'une symétrie au sein d'un
embryon (sur lequel on ne peut réaliser de greffes et
autres techniques de l'embryologie expérimentale sans
le tuer) à la suite de l'observation des
conséquences de mutations sélectionnées
revient en quelque sorte a essayer de connaître les
règles du code de la route en observant les
conséquences des accidents. Pour un biologiste
naïf comme moi, ces hypothèses ne reposent que
sur de fragiles comparaisons et un paradigme très
fort: celui du programme génétique de
développement (matériel, temporel et spatial).
A l'opposé de cette vision, on peut expliquer
à mon avis une malformation grave, avec un
arrêt de l'organogenèse pour des populations
situées dans telle ou telle partie du corps, par une
absence de détermination de la progression autonome,
due à l'inactivation de tel ou tel gène
muté - indispensable à la mise en place d'une
induction par exemple (c'est le cas des déterminants
ovocytaires notamment) - ou encore par la perte de
compétence. Si certains métamères ne se
développent pas, il existe d'autres mécanismes
qu'une information spatiale erronée (dite information
de position) pour l'expliquer. Au cours de
l'embryogénèse il est bien plus simple de
justifier du développement successif des feuillets
par des inductions et non par des déterminismes
internes aux populations qui suivraient un programme
déterminé. N'étant pas embryologiste je
ne connais pas les mécanismes histologiques de la
segmentation chez les arthropodes (j'ai lu cependant que le
mésoderme axial se creuse d'abord de cavités
cœlomiques paires métamérisées,
qui fusionneront axialement, aussi pourrait-on imaginer de
comparer les vésicules cœlomiques primordiales
avec les rosettes du schéma ci-dessous mais je ne
connais pas le mécanisme précis de la
formation des vésicules cœlomiques). Le
mécanisme ci-dessous, proposé par Rosine
Chandebois pour la mise en place des somites des
vertébrés, me semble un exemple d'un
déterminisme plus simple et plus "biologique" pour ne
pas dire vitaliste.
|
|
Un déterminisme de la
somitogénèse sous le contrôle de la
progression autonome et de la compétence des
tissus (d'après RC, p 31)
|
|
La segmentation du mésoderme paraxial en somites
est la conséquence d'un réagencement
des cellules en "rosettes", passé un seuil
critique de leur progression autonome. La
progression de la somitogénèse se fait sous le
contrôle d'inducteurs et se propage depuis
l'avant de l'embryon vers l'arrière (gradient
d'induction). La compétence des cellules
mésodermiques à former des rosettes
disparaît ensuite et si l'induction de la
somitogénèse intervient trop tard, les
rosettes ne se forment pas. Par exemple, lors d'un choc
thermique affectant quelques massifs cellulaires avant
leur induction, les membranes cellulaires sont
réversiblement altérées et si
l'induction arrive avant que les cellules n'aient
récupéré leur intégralité
cytologique, elles sont incompétentes et elles
ne formeront plus de somites, même si la
somitogenèse se poursuit normalement dans les zones
non lésées.
La longueur de chaque métamère
dépendrait de la concentration en inducteur, de sa
diffusion, de la réponse des cellules... et ne serait
bien sûr pas déterminée de façon
absolue. Sa spécificité pour une espèce
donnée dépendant des caractéristiques
des feuillets embryonnaires mis en place (taille des
cellules, nombre de cellules, types de jonctions....).
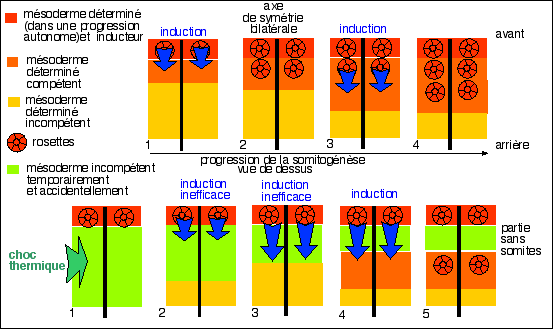
(D'après Rosine Chandebois,
Comment les cellules construisent l'animal, Phénix
éditions, 1999, p 31)
|
|
Le dernier groupe de gènes de segmentation est
constitué par les gènes sélecteurs
homéotiques qui déterminent les
caractères des segments antérieurs de la
mouche. Ces gènes sélecteurs ont pris une
importance extraordinaire depuis que des gènes
homologues (similitude de séquence proche de 90%,
homologie de fonction supposée à partir de
conséquences comparables lors de mutations;..) ont
été trouvés chez deux
vertébrés mammifères: la souris et
l'homme.
Chez la drosophile ils forment deux complexes: le
complexe bithorax et le complexe
Antennapedia qui sont réunis en un seul
complexe HOM chez d'autres insectes. On pense que les
deux complexes de la drosophile se sont
séparés à partir d'un complexe unique,
ancestral. De nombreuses mutations (à l'état
homozygote) au sein de ces complexes provoquent la mort
de la larve à l'éclosion. Tous les
gènes de ces complexes ont été
clonés et on dispose actuellement de sondes ADN pour
établir une carte spatiale du mode de transcription
de chacun des gènes sélecteurs
homéotiques par hybridation in situ. Ce sont
des gènes activés (donc à effet
zygotique) dans le blastoderme.
Chaque gène sélecteur homéotique
n'est normalement exprimé que dans les régions
qui se développent anormalement lorsque le
gène est muté ou absent. On a donc
un profil d'expression qui est fixé
définitvement puisque l'on ne peut pas
déplacer des cellules dans un embryon de drosophile
avant l'éclosion: le modèle drosophilien
montre ici de façon évidente sa limite
principale: comment expérimenter sur des
déterminismes autres que génétiques si
la seule manipulation que l'on puisse faire est d'ordre
génétique ? On suit l'expression de
gènes dans un embryon fermé et il n'y a pas de
quoi s'étonner de la similitude de
l'enchaînement des interactions moléculaires.
Pour les mammifères l'accessibilité de
l'embryon dans l'utérus n'est pas meilleure.
D'ailleurs, même le très
dogmatique Biologie moléculaire de la cellule
émet quelques réserves sur les
interprétations de l'information de position
supposée contenue dans les gènes du complexe
HOM (p 1096, &2) et c'est malheureusement(?) cet exemple
qu'ont choisi les concepteurs du programme du secondaire
pour présentee le développement aux
enfants.
Remarque:
Une brève de La Recherche (L'inconnu du
placenta, Olivier Donnars, mai 2003, 364, p 18) me
conforte dans cette vision que j'ai d'une excessive
confiance dans un paradigme (le programme
génétique). Cette brève mat l'accent
sur le lien souvent indu fait entre un gène non
fonctionnel et une anomalie de développement ou une
mort prématurée: ce n'est pas parceque la
modification d'un gène cause la mort de l'embryon que
l'on sait OU et QUAND ce gène non fonctionnel a
été une cause cellulaire d'un
phénomène qui a conduit à la mort de
l'embryon. Dans le cas de la
génétique du
développement en milieu fermé comme
on pourrait appeller les expériences sur la
drosophile, on s'expose à ne jamais pouvoir
comprendre OU et QUAND les pseudo-gènes du
développement ont été
exprimés.
|
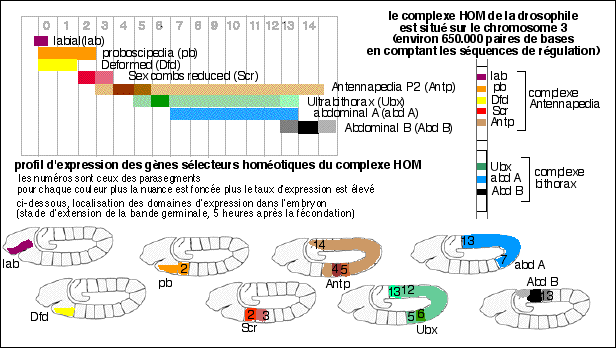
(D'après Biologie Moléculairede la
cellule, fig 21-69)
N.B. Le complexe HOM n'existe pas en tant
que tel chez la Drosophile (le nom de hom vient de la racine
homéo) mais les gènes homologues de celui-ci
corespondent à deux complexes séparés mais
portés tous les deux par le chromosome n°3. La taille
totale des deux complexes mis bout-à-bout en comptant non
seulement les séquences codantes mais aussi les
séquences de régulation avoisine les 650.000 paires de
bases. Les homologies avec des gènes sélecteurs
homéotiques de vertébrés (4 groupes HOX (A, B, C
et D) du nom "homéobox") sont proposés dans de
multiples articles et sites internet (voir biblio en début de
page et extraits sur la génèse des doigts dans
l'encadré
ci-dessus).
|
Je renvoie à la page d'histoire
de la génétique pour un encadré sur
le génome de la drosophile et les notions de carte
factorielle et de carte cytologique. Le complexe
homéotique HOM s'étend sur environ 650.000
paires de bases (séquences codantes et
séquences régulatrices, notamment les sites de
liaison aux produits des gènes de segmentation
étudiés plus haut), chiffre qu'il faut
comparer avec la distance moyenne entre deux sites qui ne
recombinent pas par crossing-over chez la drosophile:
25.000.000 paires de bases (pour une unité de
recombinaison) ou au chiffre de 1.000 à 30.000 paires
de bases qui est environ l'éventail de taille d'une
bande colorée d'un chromosome polytène - la
totalité des chromosomes comptent environ 5.000
bandes pour 140.000.000 paires de bases soit 2.800 paires de
bases pour une bande moyenne mais leur taille varie dans un
rapport de 10 - : il est clair qu'on a changé ici
d'ordre de grandeur par rapport à la
génétique morganienne. Le complexe bithorax
est situé à environ 58,7 centimorgans
(unité de recombinaison) de la mutation roughoïd
(ru), située elle-même à
l'extrémité du chromosome; la mutation sepia
(se) étant à 26,0 cmg de cette
extrêmité, scarlett (st) à 45,1, ebony
(e) à 70,7 et minute (g) à 106,2 cmg. Les
techniques d'hybridation in situ et de transgenèse
autorisent les généticiens du
développement à travailler sur des fragements
de chromosomes de plus en plus petits.
|
La technique
d'hybridation in situ
....
permet d'identifier des gènes
spécifiques à l'aide d'un sonde
radioactive directement sur les chromosomes
polytèniques de la drosophile.
Mais la technique demande de disposer d'une banque
de sondes marquées pour les gènes
recherchés.
|
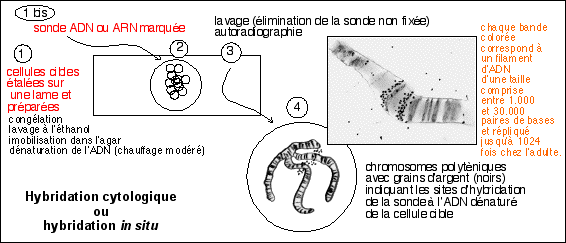
dessins et textes d'après
Gènes , fig 25-17 et
25-18
|
|
|
On notera que la disposition linéaire des
gènes du complexe HOM respecte assez bien une
orientation antéro-postérieure, comme si
l'ordre d'expression de ces gènes était aussi
celui de leur agencement le long du chromosome. On pourrait
y voir un moyen commode pour répondre à une
activation qui se ferait par propagation d'un système
d'expression le long du chromosome.
La plupart des mutations homéotiques affectent les
séquences régulatrices de ces gènes et
non les séquences codantes. Ce qui explique la
létalité de nombre d'entre elles et montre
aussi, encore une fois, que l'on est loin du simple
modèle d'un gène codant pour une
protéine qui déterminerait à elle seule
des caractéristiques d'un segment. On est toujours
confronté à un réseau
d'interactions.
Remarque:
l'observation des chromosomes polytèniques d'une
larve de Chironome (vers rouges de vase dans les magasins de
pêche) est aisée à faire en classe; la
coloration se fait habituellement au vert de méthyle
(voir par exemple; Didier Pol, Travaux pratiques de
biologie, Bordas, 2.5 p 64)
Les gènes mis en évidence par la
génétique du développement, même
si leur rôle est loin d'être aussi simple que
les appelations de gènes architectes ou gènes
de la segmentation pourrait le faire penser, sont des
gènes indispensables aux cascades d'inductions du
développement, notamment aux périodes
critiques pour lesquelles leur déficience provoque de
graves malformations.
Certains lecteurs pourraient penser
que la distinction que je fais n'est que de pure forme mais
je ne le crois pas; il est très différent de
dire qu'il existe des gènes de polarité de
l'embryon qui déterminent des gradients de
morphogènes selon des axes conceptuels
prédéfinis ou au contraire de penser que des
populations voisines en fonction de l'étape de leur
progression autonome dans lesquelles elles se trouvent,
envoient des signaux (qui peuvent être de type
chimique mais aussi déterminés par le type de
jonction cellulaire ou encore par des polarisations...) aux
populations voisines. Celles-ci répondent à
leur tour en fonction de leur avancée dans leur
propre progression autonome; la genèse
de la forme est la conséquence d'un
plan dans le premier cas alors qu'elle
est le résultat d'interactions dynamiques
entre populations dans l'autre cas. La
reproduction d'une forme dans une matière
déterminée dans un cas (un
matérialisme), et une création sans
cesse renouvellée dans l'autre (un
vitalisme).
|
|
En conclusion sur le développement
embryonnaire:
Comme pour les amphibiens (voir plus haut) on pense que la
symétrie antéro-postérieure et
dorso-ventrale de l'embryon sont mises en place dans
l'ovocyte grâce à des déterminants
présentant des gradients de concentration au sein du
cytoplasme du zygote. Parmis ces déterminants, des
ARNm transcrits d'une trentaine de gènes maternels
ont été identifiés grâce aux
conséquences des mutations affectant ces
gènes. Ces gènes codent majoritairement pour
des protéines de régulation pouvant se fixer
à l'ADN et donc activer l'expression d'autres
gènes. Les protéines
synthétisées à partir des transcrits de
ces gènes lors des premières phases de
l'embryogénèse sont considérés
par les généticiens comme des
morphogènes mais peuvent aussi être
qualifiées d'inducteurs.
|
retour plan
3. l'individu intègre les
populations en systèmes coordonnés
Une fois l'organogénèse bien commencée, on
commence à voir émerger les traits d'une organisation
intégrant les différentes populations. Ces
regroupements non plus d'abord anatomiques mais physiologiques
étaient qualifiés d'appareils: appareil
respiratoire, circulatoire, digestif... selon le type de fonction
biologique principalement réalisée pour le compte de
l'organisme animal. Au premier plan les systèmes de
communications qui sont le système nerveux pour le
milieu extérieur et le travail de relation et le
système immunitaire, qui comprend la fonction endocrine
du système nerveux , est lié à l'appareil
circulatoire, sanguin et lymphatique, et qui se charge des relations
internes entre organes.
Cette partie est présentée par Rosine Chandebois en
considérant l'individu comme un système
cybernétique (informatif) téléonomique
(orienté). Sans avoir peur des mots, j'ai du mal à les
accepter. Cependant la téléonomie est sous-jacente
à toute interprétation vitaliste.
Nous continuerons avec l'exemple de la drosophile.
|
Le développement
post-embryonnaire comprend les 3 stades larvaires de
l'asticot et le stade nymphal (pupe) jusqu'à l'imago.
Le développement postembryonnaire est donc
indirect car il présente une
métamorphose, complète (insecte
holométabole) car on distingue aisément 3
stades: larves, nymphe et imago, qui différent,
morphologiquement, anatomiquement et éthologiquement
(milieu de vie et mode de vie).
|
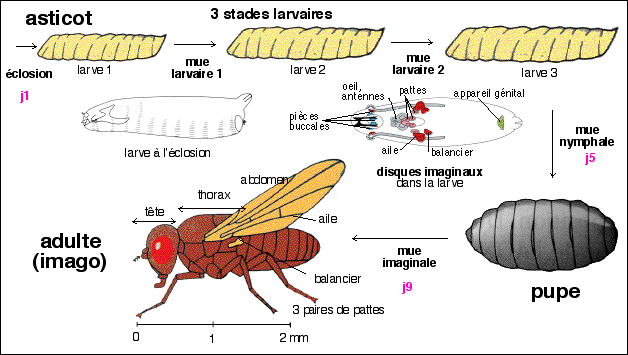
Schémas d'après Biologie
moléculaire de la cellule, modifiés
|
La larve vermiforme ou asticot se
développe habituellement dans le vinaigre qui se
forme à partir des fruits attaqués par des
levures (jus sucrés de fruits fermentés en
alcools puis acides) d'où le nom de "mouche du
vinaigre". La métamorphose qui se déroule en
toile de fond des mues (qui sont des changements de
l'enveloppe externe ou tégument de l'animal
(exosquelette) comprenant une cuticule qui, bien que souple
chez les insectes, est relativement inextensible et doit
donc être renouvellée périodiquement)
comprend des mécanismes très complexes
étudiés depuis fort longtemps par les
biologistes (je renvoie à des ouvrages
spécialisés comme Larves et
métamorphoses, Jean-Jacques Bounhiol, puf,
1980).
Le tégument (épiderme recouvert d'une
cuticule) de l'asticot représente 50% de la masse
totale de l'animal et constitue tout à la fois un
revêtement protecteur, un squelette, un organe de
réserve, un organe glandulaire multiple, et participe
grandement aux organes sensoriels et aux appareils
locomoteurs, respiratoires et digestifs. Les pièces
buccales des asticots sont réduites à deux
crochets qui dépassent légérement de
l'avancée de la partie antérieure du corps de
la larve qui recouvre la partie antérieure du tube
digestif qui se trouve ainsi au fond d'une cavité
(atrium) dans laquelle s'ouvre la bouche et
débouchent les glandes salivaires. L'appareil
excréteur, composé de 6 tubes de Malpighi est
caractéristique des arthropodes antennates. Le tissu
adipeux (ou corps adipoïde ou corps gras ou encore
trophome) est un organe de réserve mais aussi
un carrefour métabolique essentiel chez le larve,
mais qui persiste chez l'adulte, de façon moins
importante. Les cellules adipeuses fournissent
l'énergie nécessaire à la construction
des nouveaux tissus lors de la métamorphose (et des
mues) mais ont aussi des fonctions endocrines et
sécrétent par exemple les produits
précurseurs (vitellogénines) des substances de
réserve des ovocytes. Le cœur est un vaisseau
dorsal composé de 5 cavités contractiles
prolongé vers l'avant par une aorte qui amène
le sang au voisinage du cerveau et des glandes endocrines
associées. Le sang de la larve circule de l'avant
vers l'arrière dans la partie ventrale de l'animal et
dans le sens opposé dans la partie dorsale car le
cœur se trouve séparé du reste de la
cavité abdominale par un diaphragme horizontal (non
étanche) et formant ainsi un péricarde. Il n'y
a pas de vaisseaux ramenant le sang dans ce
péricarde. La respiration de la larve est
trachéenne, les trachéoles ramifiées
(non représentées sur le schéma
ci-dessous) amenant l'air au contact des cellules les plus
internes. L'air entre par des stigmates (2 à l'avant
et 2 à l'arrière de l'animal). Le
système nerveux et les organes des sens sont
rudimentaires chez la larve mais on s'est
particulièrement interessé aux glandes
endocrines, souvent associées au système
nerveux en organes neuro-endocrines, du fait de leur
intervention dans le contrôle des mues et de la
métamorphose. L'anneau de Weismann, spécifique
des Diptères supérieurs, enroulé autour
de l'aorte est formé par la réunion des
corpora allata (qui sécrétent notamment
l'hormone juvénile, maintenant l'état
larvaire), des corpora cardiaca et des glandes
prothoraciques (ou péritrachéennes)
latérales. Le cerveau (et plus spécialement
les cellules sécrétrices de la pars
intercerabralis) contrôle les corpora
allata en inhibant ou en stimulant en fonction des
périodes du développement (par des
neurosécrétions) la sécrétion de
l'hormone juvénile qui est l'hormone principale qui
inhibe les ébauches imaginales (on connaît
plusieurs formes (6) pour cette hormone (des
sesquiterpènes apolaires apparentés à
l'isoprène C5) dont la fonction varie selon sa
structure moléculaire, ce qui explique des
rôles antagonistes, et dont les protéines de
transport modulent la destruction enzymatique). Mais les
hormones juvéniles interviennent aussi dans les mues
et dans de nombreuses autres fonctions, par exemple dans la
vitellogénèse. Les nombreuses hormones du mue,
dont la première isolée fût l'ecdysone,
sont des hormones stéroïdes (principalement
l'ecdysone et la 20-hydroxyecdysone) dont les
récepteurs sont de facteurs de transcription qui se
fixent à l'ADN. Les ecdystéroïdes,
nom désignant ces hormones "de mue" sont
sécrétées, sous le contrôle de
neurosécrétions, par les glandes
prothoraciques (parties latérales de l'anneau de
Weismann chez la drosophile) au cours des stades
post-embryonnaires puis par le follicule ovarien à
maturité sexuelle.
Les cellules musculaires, celles des glandes salivaires et
des tubes de Malpighi, tout comme les cellules intestinales
de l'asticot, sont polyploïdes. Les tissus larvaires
polyploïdes sont très nombreux et à la
métamorphose ils sont profondemment modifiés
et ne sont plus polyploïdes chez l'adulte. On
considère que plus un tissu est polyploïde moins
il subsiste lors de la métamorphose. Les tissus
faiblement polyploïdes (jusqu'à 10n) sont
parfois renouvellés par des mitoses anormales dont
les cellules filles diploïdes se développent
seules et renouvellent le tissu.
Les ébauches imaginales (du nom de l'adulte ou
imago) sont formées par des
populations quiescentes chez la larve (petits amas
blanchâtres que l'on peut disséquer au
microscope chez l'asticot... voir schéma ci-dessous)
mais qui se développent rapidement
(histogénèse) et donneront naissance
à des organes cachés chez la nymphe puis, par
simple extension (croissance), formeront les organes
spécifiques de l'adulte: organes liés au
travail de relation du fait du changement de mode de vie
entre la larve et l'imago (yeux composés, pattes,
ailes... mais aussi muscles qui possèdent des
myoblastes imaginopotents) organes liés au travail de
nutrition (remaniements profonds de l'appareil disgestif
...), organes liés au travail de reproduction qui
dans la plupart des cas est propre à l'imago (organes
copulateurs...). Chez l'asticot des Diptères les
populations imaginales sont organisées en
disques, qui sont des invaginations
épidermiques qui peuvent s'enfoncer très
profondément dans le corps de la larve) et en
histoblastes, plus disséminés mais
disposés de façon très précise.
L'organisation en disques n'est pas absolue chez tous les
insectes. Les larves des Coléoptères par
exemple, n'ont pas de disques imaginaux pour les pattes et
les ailes mais certaines populations cellulaires
dispersées de la larve sont déterminées
précocement et peuvent ,par des expériences de
greffe, déterminer l'apparition d'organes
rudimentaires déplacés. Il est à noter
que les expériences d'ablation de disques
imaginaux ou d'histoblastes ou encore de populations
à destinée histogénétique,
conduisent toujours à des déficits
anatomiques: il n'y a pas de régulation ni de
dédifférenciation de tissus voisins.
Cependant, l'ablation chez une larve âgée de
drosophile d'un demi-disque oculaire fournit une mouche
ayant de ce côté un demi-œil.
Lors de la métamorphose, on observe de très
nombreuses histolyses des tissus larvaires (tube
digestif et formations annexes, muscles, trachées,
épiderme, glandes produisant notamment la soie du
cocon de nombreuses nymphes...), notamment par des
mécanismes d'apoptose (voir annexe).
Classiquement on parle aussi de remaniements pour des
modifications affectant des tissus larvaires qui se
transforment en tissus imaginaux sans mourir.
|
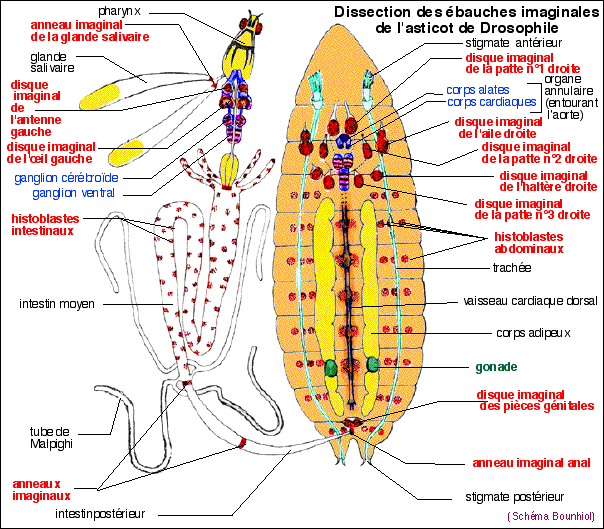
|
La métamorphose n'est aussi brusque et nette que
chez les insectes dits holométaboles qui comprennent
l'ordre des Diptères (mouches, moustiques...) ou
encore les Coléoptères, les
Lépidoptères ou les
Hyménoptères. Plus les insectes sont primitifs
et moins leur métamorphose est marquée.
Les expériences de microchirugie sur les
larves sont plus facilement couronnées de
succès que les tentatives sur le blastoderme.
On a pu dès 1931 (travaux de Geigy) montrer par des
destructions spécifiques dirigées grâce
à des irradiations ultraviolettes que les
populations cellulaires de la larve et celles de l'imago qui
coexistent en sont sein sont suffisamment
indépendantes pour obtenir des asticots viables avec
des populations imaginales détruites alors que
l'imago est alors défiscient et non viable.
Si l'on transplante un disque imaginal à la place
d'un autre dans la larve, et si on laisse ensuite la larve
se métamorphoser, le disque greffé se
différencie de façon autonome
conformément à sa détermination,
indépendamment de son site d'implantation. Les
biologistes moléculaires (Alberts et al., 1097)
concluent : « cela signifie que les cellules du
disque imaginal sont gouvernées par une
mémoire de leur position initiale. Les gène
sélecteurs homéotiques sont des composants
essentiels du mécanisme de la mémoire. S'ils
sont éliminés des cellules des disques
imaginaux au cours de la longue période qui conduit
à la différenciation au moment de la
métamorphose, les cellules se différencieront
en structures incorrectes comme si elles appartenaient
à un autre segment du corps »(voir
ci-dessous). Il me semble nettement plus simple de voir dans
cette détermination une des caractéristiques
d'une population engagée dans une progression
autonome, la mémoire étant celle d'un profil
métabolique qui conduira à la
différenciation en organe imaginal. Le fait de
pertuber génétiquement le développement
autonome conduit parfois celle-ci à stopper
irrémédiablement le cours de la progression
autonome et produit des tissus désorganisés
qui pourraient parfois s'engager dans une nouvelle
détermination.
Un exemple peut-être démonstratif est
proposé par Biologie moléculaire de la
cellule, p 1101-1102 avec les soies (appelées
fort injustement poils dans l'ouvrage) et
interprété de façon à mon avis
rocambolesque alors que des solutions plus simples
s'offrent. Les soies sont issues de cellules
épithéliales embryonnaires dont certaines sont
aussi présentes dans les disques imaginaux. Deux
mutations (achaete et scute) ont
été localisées dans une zone voisine et
codent pour des protéines de régulation de la
transcription dont l'absence empêche la formation de
soies et l'ajout par transgénèse, l'apparition
de soies supplémentaires (où ? sur un disque
imaginal qui n'en comprend pas d'habitude ? autre part ?,
comment ? combien ?). Si l'absence de soies peut
aisément s'expliquer dans le cas d'une anomalie
génétique, l'apparition de soies
excédentaires relève d'un autre type de
mécanisme. En effet, il a été mis en
évidence que les cellules mères embryonnaires
des soies inhibaient latéralement les cellules
voisines pour éviter que des soies contigues ne se
developpent. En cas de déficit moléculaire de
cette inhibition (encore produit par une série de
mutation touchant les gènes des médiateurs et
de leurs récepteurs), des ilôts de cellules
mères adjacentes se développent et forment des
amas de soies. Ces expériences, loin de conforter des
hypothèses de contrôle génétique,
mettent plutôt à l'honneur la communication
entre populations, leur développement autonome sous
le contrôle des interactions entre populations
voisines. L'universalité des médiateurs ne
peut que confirmer l'idée que la recherche d'une
individualité doit se faire au moins au niveau
cellulaire et non au niveau moléculaire.
La technique de recombinaison mitotique induite par
les rayons X (brève irradiation focalisée
sur des tissus épithéliaux) est une forme de
chirurgie génétique qui permet de marquer
certaines cellules superficielles. Appliquée à
tissus d'un hétérozygote pour des mutations
dans les gènes homéotiques, on a pu observer
des recombinaisons homologues qui font que les tissus
traités aux rayons X présentent parfois des
territoires de cellules homozygotes alors que le reste de la
larve est hétérozygote.
|
|
Conclusion intermédiaire
Le développement post-embryonnaire fait appel
à des interactions extrêmement
diversifiées entre populations très nombreuses
et la génétique moléculaire devient un
outil fort délicat à manier. Son utilisation
sur des populations imaginales déterminées
dans la larve (disques imaginaux) permet de retrouver le
même contexte expérimental si cher aux
généticiens moléculaires que celui de
l'embryon dans ses enveloppes : dans une population
engagée dans une progression autonome
(déterminée), on observe l'activation
séquentielle de très nombreux gènes que
l'on peut étudier grâce à des mutations.
La cascade des interactions supposée gouverner la
morphogenèse de l'imago ne se trouve certainement pas
exprimée dans cette population déjà
déterminée mais c'est l'ensemble de l'animal
qu'une théorie du développement
post-embryonnaire doit prendre en compte, ce qu'est bien
incapable de faire une théorie d'un plan
d'organisation génétiquement
déterminé et séquentiellement
exprimé. La théorie de Rosine Chandebois qui
tient compte du rôle des hormones me paraît
autrement mieux armée pour répondre à
ces questions.
|
|
Le système individu
dans la théorie de Rosine Chandebois
|
L'embryon qui pouvait aisément être
regardé comme un ensemble de populations en
interaction dynamique mais relativement
indépendantes, est devenu maintenant une larve qui
est un individu autrement plus complexe et surtout
coordonné. C'est pour cela que j'ai essayé de
détailler un peu la vie de la larve ci-dessus. Pour
rendre compte de ce niveau supérieur d'organisation
les mêmes mécanismes sont sans aucun doute
nécessaires mais sont-ils suffisants ?
Rosine Chandebois affirme (RC, p 52): « Parce
qu'elle est la conséquence de la progression de la
différenciation tissulaire qui morcelle l'embryon en
territoires de plus en plus spécialisés, la
reproduction de l'architecture de l'adulte commence par les
grands volumes et s'achève par les détails.
Chacune des déterminations qui se succèdent
dans la génèse d'un tissu entrâine
obligatoirement un réajustement d'ensemble d'une
population de cellules. Chaque détermination
provoquant la ségrégation d'une population,
chaque nouvelle ébauche emporte une partie de
l'organisation créée lors du
réajustement précédent,
conservée par la mémoire individuelle et
collective des cellules et compliquée par
l'émergence de nouveaux traits qui interfèrent
avec elle. Ainsi, l'enchaînement des PA entraîne
une complication progressive de l'organisation de l'embryon.
Les traits qui émergent au cours de cette succession
de réajustements concernent des populations de plus
en plus restreintes et revêtent ainsi de moins en
moins d'importance. Chaque réajustement complique
l'environnement des populations voisines, et en
conséquence, les modalités de leurs
réajustements respectifs, de telle sorte que les
interactions cellulaires deviennent de plus en plus
inextricables.» Là encore le modèle
de la drosophile est particulièrement peu propice
à la compréhension du développement
étant donné la cohabitation des populations
larvaires et imaginales chez l'asticot.
Le rôle des hormones est ici majeur:
« Le rôle des hormones dans
l'achèvement du développement (p53)
Dans plusieurs lignées cellulaires, la
différenciation terminale installe une fonction
endocrine. Les hormones apparaissent dans le sang circulant.
Leurs concentrations respectives augmentent, puis se
stabilisent déclinent éventuellement, selon
des chronologies différentes. Ainsi, pendant tout le
déve loppement, la CONJONCTURE HUMORALE est
constamment modifiée.
Un tissu donné réagit à une hormone
donnée lorsque la concentration de celle- ci
dépasse une certaine valeur ou SEUIL
RÉACTIONNEL. Chaque tissu réagit en fonction
de son identité, ce qui entraîne auto
matiquement de nouveaux réajustements. C'est pourquoi
l'installation de la fonction endocrine joue un rôle
capital dans l'achèvement du
développement.
La mise en circulation des hormones a pour effet de modifier
les activités spécifiques des tissus et ainsi
de compliquer l'organisation acquise. En conséquence,
l'organogenèse se prolonge au delà des limites
atteintes par le jeu des inductions embryonnaires.
Chaque tissu de l'organisme acquiert à un certain
stade une compétence particulière et
répond ainsi à l'apparition d'une hormone
d'une façon particulière. On distingue quatre
types de réactions :
- la RELANCE DE LA P.A., qui se traduit par la reprise du
développement dans une ébauche restée
à l'état embryonnaire.
- le BLOCAGE DE LA P.A., qui maintient une ébauche
à l'état indifférencié (ou non
fonctionnel), et dont les effets peuvent, à la
longue, devenir irréversibles.
- une MODULATION, c'est-à-dire un changement dans la
composition des substances spécifiques
élaborées par un tissu déjà
fonctionnel.
- la CYTOLYSE provoquée par la production accrue
d'enzymes lytiques.
Dans certains cas, un tissu réagit seulement à
la transformation d'un tissu voisin déterminée
par une hormone à laquelle il est lui-même
insensible. De ce fait, la libération d'une hormone
peut provoquer de nouvelles inductions qui
parachèvent le morcellement de l'embryon et font
apparaître de nouveaux organes.
Lorsque les compétences des tissus sont
épuisées, en chacun d'eux les modifications de
la conjoncture humorale se répercutent seulement sur
les " valeurs" des cellules, et donc sur leur
activité mitotique. La croissance
différentielle - dont le rôle fut
éclipsé au cours de l'organogenèse par
" importance des réagencements cellulaires - est
maintenant seule à l'oeuvre. Ainsi, elle modifie et
révèle les structures en gradient
invisibles. » Mme Chandebois applique sa
théorie à l'étude de la
métamorphose des amphibiens (RC, p 56) mais ces
lignes s'appliquent aussi fort bien au développement
post-embryonnaire des insectes.
La conclusion du chapitre est la suivante (RC, p 66):
« Le système «individu» et
l'automatisme de l'ontogenèse
L'individu se présente comme un système
cybernétique téléonomique ayant pour
fonction de coordonner les contrôles qu'exercent les
systèmes " population cellulaire" les uns sur les
autres et, par là, leurs activités
respectives. Pendant sa période
d'autopoïèse ( le développement), le
système " individu" harmonise la
ségrégation et la structuration des
systèmes " population", puis maintient leur
organisation une fois qu'il est amorti ( adulte).
Le système " individu" fonctionne à coups de
déclenchements qui s'enchaînent automatiquement
: les déterminations qui apportent chacune d'infimes
modifications dans les activités cellulaires, mais
qui, en raison des réajustements, entraînent
des complications structurales parfois considérables,
programmées jusque dans leurs moindres détails
par les événements antérieurs du
développement. Ces facultés
d'autopoïèse sont considérablement
accrues par l'instauration d'une communication à
distance : la mise en circulation des hormones qui permet
l'utilisation de compétences
précédemment acquises.
Des régulations de structures sont possibles à
l'échelle du système " individu", mais, chez
l'embryon comme chez l'adulte, elles sont restreintes en
fonction de la spécialisation des cellules et de la
complexité de l'organisation acquise. Si on met
à part ces cas particuliers, toute anomalie
structurale qui s'introduit dans le système "
individu" par suite d'un dysfonctionnement temporaire
(génétique ou autre) ou d'une modification
topographique provoquée par un acte chirurgical,
n'est jamais corrigée. Ou bien l'enchaînement
automatique des interactions dans le système "
individu" est interrompu et le développement avorte.
Ou bien, il est de plus en plus faussé parce que
l'anomalie, conservée par la mémoire
collective des cellules, fausse le fonctionnement des
systèmes " population cellulaire" engendrés
par la ségrégation du système
initialement touché et se répercute sur
d'autres. »
|
|
Conclusion empruntée à Mme Chandebois (RC,
p 67)
«Les cellules étant vues comme des organismes
susceptibles de survivre isolement et douées d'un
comportement complexe, le système "individu"
apparaît comme une société de
progrès, dont les principes de fonctionnement sont
tout à fait comparables à ceux des
sociétés humaines. Les deux types de
systèmes doivent leur pouvoir
d'autopoïèse considérable aux
capacités des individus qui les constituent : des "
personnalités" diversifiables à
l'extrême, la communication qui enrichit et entretient
une mémoire collective ( sans laquelle un
progrès ne peut faire naître de nouvelles
compétences), des déplacements de populations
qui créent de nouveaux échanges, 1"'invention"
de la communication à distance qui bouleverse les
structures de la société et qui rendent
possibles de nouveaux progrès.»
|
retour plan
|
Les techniques de
la génétique du
développement
|
|
mutation
|
on sélectionne un mutant dans une population et on
s'assure qu'il présente une permanence de sa mutation
sur un grand nombre de générations.
|
en cours de
rédaction...
|
|
hybridation in situ
|
avec sonde à ADN
|
|
avec sonde à ARN
|
|
isolement des gènes
|
étude des produits
|
|
transgenèse
|
|
|
hybrides de cellules mutantes
|
|
|
microchirurgie
|
échange de cytoplasme dans l'embryon
précoce
|
|
disques imaginaux
|
|
recombinaisons génétiques
|
|
|
|
*apoptose: voir l'article de Jean CLOS et
Yves MULLER dans Biologie-Géologie (Bulletin de l'APBG)
n°2-2001, p 307-341: L'apoptose, une mort cellulaire
programmée (retour texte); on
distingue l'apoptose ( du grec apo = achèvement et
ptôsis = la chute, qui désignaient ainsi la chute des
feuilles mortes ou des pétales fanées) qui est une
mort naturelle au cours de laquelle la cellule participe
activement à sa destruction sous le contrôle de signaux
externes et la nécrose où la mort de la
cellule est accidentelle et passive. On distingue aussi l'aptotose
d'autres suicides cellulaires ou morts cellulaires programmées
comme l'autophagie (formation d'autophagosomes et condensation de la
chromatine) ou la mort cytoplasmique (dilatation de l'enveloppe
nucléaire et des organites...) par les
phénomènes cytologiques et les conséquences au
niveau de l'organisme. En effet lors d'une nécrose la cellule,
ou le groupe de cellules habituellement, éclate et provoque
une réaction inflammatoire alors que l'apoptose affecte
généralement une cellule isolée qui se morcelle
en petits corps apoptiques qui sont éliminés par les
phagocytes et qui ne provoquent pas de réaction inflammatoire.
L'apoptose intervient très couramment dans le
développement embryonnaire mais aussi au cours de la vie et
touche tous les tissus: système nerveux, système
immunitaire... Les mécanismes moléculaires reposent sur
les mitochondries qui seraient le régulateur central du
mécanisme de l'apoptose par la libération de nombreuses
molécules déclenchant ou intervenant dans l'apoptose.
Certains auteurs pensent que l'apoptose serait un cycle cellulaire
avorté.