II. Mécanismes de
l'immunité (2ème
partie)
Nouveau
cours 2008 :
généralités
- SIDA
-VIH
Tout ce chapitre correspond à une refonte des
éléments du programme dans un souci de cohérence
avec la conception de la vie présentée dans le cours de
seconde.
Étant donné que certaines affirmations de ce cours
peuvent parfois surprendre, j'ai indiqué une
référence précise de la source utilisée
(essentiellement : Immunologie de J.P. Revillard, De Boeck
Université, 1995 ; La tuberculose, Véronique
Vincent, 1998, Pour la Science, Dossier "Les maladies
émergentes" ; Tuberculose, chiffres et
polémique, Roy M. Anderson, 1999, La Recherche, 319, avril
1999; La tuberculose, mythes et réalités,
Olivier Neyrolles et Brigitte Gicquel, Pour La Science, 303, janvier
2003, 46-53; Les virus herpès humains,
Hélène Collandre et Alberto Epstein, 1998, Pour la
Science, Dossier "Les maladies émergentes" ;
Microbiologie, Prescott, Harley et Klein, 1995, De Boeck
Université - un article à ajouter ce Noël 2001:
La cellule-mémoire, gardien de l'immunité,
Henrique Veiga-Fernandes, La Recherche, 349, janvier 2002, 38-41)
1 . A la recherche de l'identité de
l'homme ; 2 . L'homme, milieu de vie
;
3 . L'homme blessé ; 4 . L'homme
malade; 5 . L'homme sain
TP: le système immunitaire: des
cellules et des organes -
TD: retour sur les cellules et les
molécules du système immunitaire
retour sommaire cours Terminale S
3. L'homme
blessé
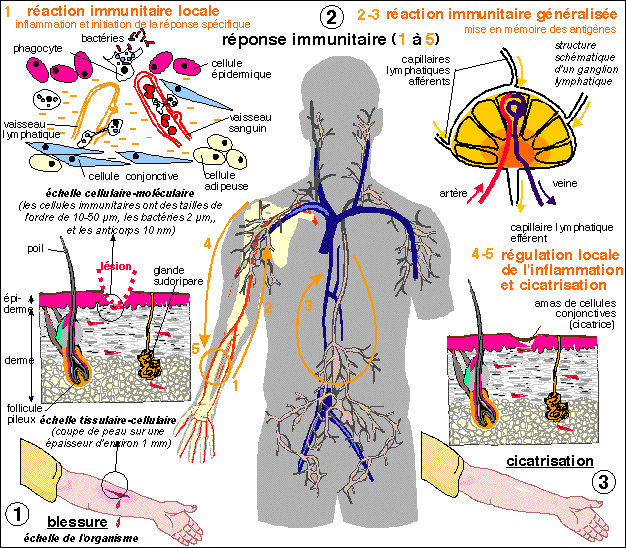
Un schéma de la réponse immunitaire à une
blessure superficielle dont la principale qualité n'est
certes pas la précision.... l'objectif est de
"montrer" la profonde unité et la coordination de la
réponse immunitaire au niveau local et général
ainsi que le rôle prépondérant des appareils
circulatoires lymphatiques et sanguins. La réponse est locale,
puis générale, puis de nouveau locale. Les principales
phases sont citées ci-dessous.
1 . la blessure atteint le derme, vascularisé, car elle
saigne. Sur la coupe très schématique on distingue un
poil (constitué par des filaments organisés d'une
protéine : la kératine, celle que l'on retrouve au
niveau de la couche cornée de l'épiderme, mais aussi
des ongles...) et son follicule pileux qui lui donne naissance.
2 . La réaction immunitaire se déroule d'abord
localement (1) par une
inflammation. Des phagocytes (voir ci-dessous) accourus sur les lieux
de la lésion capturent les bactéries et les
débris des cellules lésées. On voit ici que les
cellules arrivant sur les lieux de la lésion viennent des
appareils circulatoires tant lymphatique que sanguin. Les phagocytes
migrent ensuite (2) vers les
ganglions lymphatiques ou les tissus lymphoïdes les plus proches
(ici ce sont les ganglions de l'aisselle car le point de
pénétration n'est pas une muqueuse). C'est au sein des
ganglions que va avoir lieu la réponse immunitaire
spécifique et généralisée à de
nombreux autres types immunitaires que les phagocytes (voir
ci-dessous). De là, les cellules immunitaires migrent
(3) dans tout l'organisme
grâce encore aux appareils circulatoires lymphatique et
sanguin.
3 . La phase locale de cicatrisation est
contrôlée (4) par
des mécanismes encore mal connus
(5).
Quelques précisions sur les principales étapes des
réponses immunitaires suite à une blessure
superficielle :
- inflammation : ensemble de réactions complexes
de défenses non spécifiques de l'agent qui les a
causées. Trois signes cliniques principaux : rougeur
(dilatation des vaisseaux sanguins et donc augmentation du
flux sanguin au niveau de la zone lésée),
gonflement (souvent se forme un œdème,
c'est-à-dire une poche de lymphe interstitielle
formée à partir du plasma qui sourd entre les
cellules endothéliales des vaisseaux sanguins distendus),
chaleur (essentiellement due à l'afflux sanguin mais
aussi à la libération de substances pyrogènes
: capables de provoquer la fièvre),
douleur (c'est l'œdème qui souvent comprime les
terminaisons nerveuses du derme, mais il peut y avoir des toxines
libérées par les bactéries infectieuses ou
des substances libérées par les cellules
lésées qui ont le même rôle..),.
L'inflammation conduit à une altération de la
fonction de l'organe ou du tissu lésé. Les
mécanismes de l'inflammation reposent sur la
libération de nombreuses substances chimiques qui causent
tous ces événements.
- On observe l'arrivée massive de globules blancs dont le
rôle est de "capturer" les éventuelles
bactéries ayant pénétré lors de la
blessure et de nettoyer les tissus lésés en
absorbant les cadavres des cellules mortes. Cette intense
activité est appelée phagocytose (du grec
phagein = manger) et les cellules des phagocytes. Cette
phase est le point de départ de la réponse
immunitaire spécifique qui va dépendre de
l'antigène c'est-à-dire de la substance ou de
l'organisme qui a été phagocyté. Un
antigène est un élément susceptible de
déclencher une réponse immunitaire
spécifique.
- les phagocytes qui ont "capturé" l'antigène
vont migrer vers les ganglions lymphatiques ou les
tissus lymphoïdes les plus proches (ici les ganglions
de l'aisselle) et entrer en communication avec de
nombreuses autres cellules immunitaires du groupe des lymphocytes.
La communication est établie par voie chimique
(médiateurs endocrines, paracrines ou autocrines: voir
cours de physiologie pour ces
termes). mais aussi par des contacts membranaires facilités
par le gonflement du ganglion au niveau duquel le flux de lymphe
augmente (lors d'une infection les ganglions lymphatiques
deviennent sensibles à la palpation, parfois douloureuse).
C'est ainsi que l'information immunitaire (nature de
l'antigène essentiellement) va être transmise
à tout l'organisme par l'intermédiaire des cellules
qui vont être entrées en contact les unes avec les
autres au niveau des ganglions ou des tissus lymphoïdes. On
assiste alors à une généralisation de la
réponse immunitaire et à ce que l'on qualifie de
mise en mémoire de l'antigène. Cette mise en
mémoire de la nature antigènique sert d'explication
pour justifier qu'une réponse immunitaire est souvent plus
rapide lors de la seconde exposition à un antigène,
ce qui fonde l'utilisation de vaccins qui sont des
préparations contenant des antigènes sans pouvoir
pathogène (du grec pathos = souffrir). La
réponse immunitaire elle-même dépend de
l'antigène est peut aller de la sécrétion de
substances neutralisant ou lysant l'antigène (les anticorps
par exemple qui sont des glycoprotéines
sécrétées par certains lymphocytes) à
une action de phagocytose ou de lyse dirigée et
stimulée par d'autres cellules (la lyse d'une
cellule est son éclatement).
La réponse locale qui avait commencé par
l'inflammation se termine aussi par des contrôles locaux :
vasoconstriction, stimulation de la division des fibroblastes
(cellules conjonctives) qui vont colmater la plaie
(cicatrisation)... Le pus d'une plaie correspond à la
lymphe interstitielle avec des gouttelettes de lipides, des
cadavres de bactéries et des débris de cellules
mortes venant de l'organisme. On est loin de connaître tous
les éléments qui contrôlent les étapes
de la restauration de la fonction du tissu
lésé.
Lors d'une blessure accidentelle certains organismes
étrangers pénètrent dans l'organisme. La plupart
du temps ils sont déjà présents à la
surface ou dans l'organisme mais ils changent de milieu et passent
d'un milieu surveillé, confiné, à un nouvel
espace, où ils ne sont pas les bienvenus. Les
mécanismes non spécifiques de défense de l'homme
mis en jeu à la suite d'une blessure, ou d'une lésion
produite par un agent pathogène, sont regroupés sous le
terme de réaction inflammatoire ou plus
précisément d'inflammation. Cette
réaction de type inflammatoire conduit à
l'élimination des éléments étrangers
essentiellement par phagocytose.
L'inflammation est donc une réaction
défensive de l'organisme. L'inflammation est non
spécifique d'une cause particulière (par exemple un
type de microbe), localisée (à une blessure ou à
un tissu), et présente 5 caractéristiques :
douleur, chaleur (élévation de
température), gonflement (œdème) et
rougeur, de la région atteinte et altération
de la fonction du tissu lésé. Ces signes cliniques
sont dus à des événements physiologiques et
cellulaires qui sont extrêmement complexes et dont voici juste
un aperçu :
- libération du contenu cytoplasmique des cellules
lésées provoquant une diminution du pH qui active
à son tour des systèmes enzymatiques produisant des
substances variées, mais essentiellement une enzyme
(bradykinine) qui provoque l'ouverture des espaces entre les
cellules de l'endothélium vasculaire des capillaires
sanguins et leur gonflement (vasodilatation) et donc la
fuite du plasma (œdème, rougeur et chaleur par
augmentation du flux sanguin) et l'afflux de globules blancs
(essentiellement des polynucléaires neutrophiles). D'autres
substances (prostaglandines par exemple) se fixent sur les
terminaisons nerveuses et provoquent la douleur, d'autres encore
sont des anticoagulants (héparine).
- activation de globules blancs particuliers (mastocytes,
polynucléaires basophiles) libérant des substances
attractives (histamine) pour les autres globules blancs. Les
globules blancs (notamment les phagocytes - voir plus bas) se
dirigeant activement vers les tissus lésés, on parle
de chimiotactisme (qui est un déplacement
orienté par une substance chimique).
- libération de substances chimiques antimicrobiennes par
les tissus blessés, par exemple certains facteurs
plasmatiques appartenant au complément (voir plus
bas).
- destruction des organismes étrangers (bactéries,
mycétes ou petits parasites) et des cellules
infectées ou mortes par phagocytose. La phagocytose
est un mécanisme d'ingestion cellulaire (capture,
internalisation) de particules d'assez grande taille et de lyse
(dégradation, rejet) réalisée par les
phagocytes, c'est-à-dire toute cellule douée
de pouvoir de phagocytose. Les phagocytes sont les leucocytes de
type granulocytes (ou polynucléaires)
neutrophiles et les cellules de la lignée
monocytes/macrophages : les monocytes, circulants, donnant
les macrophages, tissulaires.
|
La
phagocytose
|
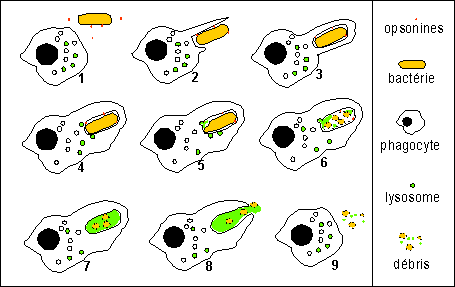
Principales étapes de la
phagocytose d'une bactérie:
1-chimiotactisme, déplacement du phagocyte
attiré par la bactérie
2-capture de la bactérie par émission
de pseudopodes par le phagocyte, capture souvent
facilitée par des molécules d'adhésion
se fixant sur la bactérie : les opsonines
3-formation d'un phagosome ou vacuole de phagocytose
(endocytose ou internalisation)
4-5-6-7- lyse de la bactérie
(bactéricidie) par des mécanismes
variés, certains mettant en jeu l'oxygène,
à partir des éléments contenus dans
des lysosomes (enzymes lytiques par exemple)
8-9-rejet par exocytose des débris
bactériens
(Remarque: dans certains cas la bactérie
peut résister à la lyse et persister dans le
cytoplasme du phagocyte et même s'y diviser et
provoquer la mort de celui-ci, c'est alors le point de
départ d'une infection)
|
Remarque (au 8/12/2001):
Le document de l'APBG: La peau humaine, coproduction
APBG-INSERM, est une excellente source documentaire qui permet de
compléter cette partie si un collègue souhaite
présenter la blessure comme exemple de point de départ
d'une réaction immunitaire spécifique. Dans ce cas ce
sont les cellules de Langerhans de l'épiderme qui jouent le
rôle de cellules présentatrices d'antigène (CpAg)
(p 54-55) et qui migrent vers les ganglions lymphatiques pour
présenter les déterminants antigéniques en
association avec les molécules HLA aux lyphocytes T. Il y a
même un exercice proposé (p 48-49).
4. L'homme
malade
|
Remarque bis:
Les organismes ou les molécules à l'origine de
maladies (pathogènes) peuvent prendre plusieurs noms
: on a pris l'habitude de parler d'agent pour les
virus pathogènes (ou les viroïdes (acides
nucléiques nus) ou les prions (protéines
nues)... pour une discussion sur les caractères du
vivant voir la fiche sur la diversité
du vivant), de micro-organismes pour les
bactéries et les champignons, de parasites
pour les unicellulaires et les animaux. Cependant, on
emploiera, comme c'est l'usage, le terme très
général d'agent
pour désigner la cause directe d'une maladie
que celle-ci soit un agent (viral), un micro-organisme ou un
parasite.
|
Lorsqu'un agent se développe et se multiplie (ou est
multiplié) dans, ou sur, ou encore par,un hôte, ce
dernier subit une infection. Une infection peut ou non
conduire à une maladie (pathogénie). Une
maladie infectieuse est une modification d'un état
de bonne santé par un agent qui se multiplie (ou est
multiplié) et qui provoque, pour la totalité du corps
ou pour une partie de celui-ci, une incapacité à
réaliser ses fonctions. Tout agent causant une maladie est
qualifié de pathogène. Sa capacité
à provoquer une maladie est appelée "pouvoir
pathogène". Celui-ci est mesuré par ce que l'on
nomme la virulence d'un agent. Cette virulence
déterminée expérimentalement par le nombre
d'agents pathogènes capables d'infecter (dose infectieuse 50
ou DI50) ou de tuer (dose létale 50 ou
DL50) 50% des hôtes d'un groupe expérimental
("modèles" animaux ou cultures cellulaires...). La virulence
est elle-même sous la dépendance de trois facteurs
qualifiés de pouvoirs : pouvoir invasif
(capacité à se répandre dans les tissus voisins
du foyer d'infection), pouvoir infectieux (capacité
à établir un foyer infectieux localisé) et
pouvoir toxinogène (capacité à produire
des toxines, substances chimiques nuisibles à
l'hôte).
|
Remarque :
La fièvre semble presque
toujours avoir pour origine la libération, par
l'agent pathogène, de substances
pyrogènes (déclenchant la
fièvre, du grec pûr = feu et
gennan = engendrer). Ces substances provoquent une
perturbation de la thermorégulation essentiellement
sous le contrôle de l'hypothalamus (zone située
à la base du cerveau dont on reparlera lors de
l'étude des hormones sexuelles). L'accès de
fièvre correspond à une température
orale (de la bouche) supérieure à 37°C ou
une température rectale (du rectum, autre
extrémité du tube digestif) de 37,5°C. La
fièvre semble avoir pour résultat de stimuler
les défenses de l'hôte par stimulation du
système immunitaire et inhibition de la croissance
bactérienne en diminuant le fer disponible dans le
sang.
|
On peut distinguer plusieurs étapes dans une maladie :
voici un exemple de description de ces étapes :
- Du milieu extérieur au milieu intérieur (voir
les parties précédentes de ce chapitre) :
* Transmission de l'agent (direct : d'un corps à un
autre, par des aérosols (toux, éternuements...), par
la nourriture, par une plaie, par un vecteur (comme un animal, un
insecte parasite...)...
* Invasion de l'hôte : soit par une plaie ayant
donné directement accès au milieu intérieur
soit par les muqueuses ce qui nécessite alors la fixation
sur ces cellules puis la pénétration intracellulaire
pour certains agents.
- De l'infection à la maladie :
L'évolution d'une maladie dépend de trois facteurs
essentiels: 1- le nombre d'agents pathogènes
présents dans l'hôte ; 2- la virulence de l'agent
pathogène ; 3- les défenses de l'hôte
(degré de résistance).
4.1 Une maladie bactérienne à multiplication
intracellulaire : la tuberculose
Avertissement : le but de cette partie
n'est pas une étude de la maladie mais une étude du
déroulement de la réponse immunitaire suite à
une invasion bactérienne.
La maladie : Les symptômes de la tuberculose
sont la fièvre, la fatigue et la perte de poids. Une toux,
caractéristique des maladies pulmonaires, peut entraîner
des expectorations de crachats sanguinolents.
La maladie est une infection c'est-à-dire que le
pouvoir pathogène de l'agent de la tuberculose résulte
directement de la multiplication du parasite dans les cellules, ce
qui provoque la nécrose (mort) des tissus (la plupart
du temps le tissu pulmonaire mais l'agent pathogène peut aussi
s'étendre à d'autres tissus). (N.B. : Une
deuxième forme de maladie (comme c'est le cas par exemple pour
le choléra, le tétanos, la diphtérie...) peut
être une intoxication : lorsque le germe
secrète une toxine ou substance nocive).
Cependant, la virulence du bacille semble aussi
passer par de nombreuses molécules,
sécrétées ou non; on a ainsi isolé
très récemment une protéine
sécrétée par le bacille et qui lui permettrait
de coloniser d'autres organes que les poumons; on connaît aussi
une enzyme (isocitrate lyase) interne qui permet à la
bactérie de survivre en conditions anaérobies au sein
du granulome (voir ci-dessous). On pourrait ainsi citer de nombreux
autres moyens de défense de la bactérie qui augmente
son pouvoir pathogène.
A la fin du 19ème siècle, à l'époque de
Koch, la tuberculose était responsable d'un
décès sur 7 en Europe et atteignait un jeune adulte
actif sur 3. En 1998, un tiers de la population mondiale est
infectée par le bacille tuberculeux (plus d'un milliard de
personnes) et environ 8 millions de nouveaux cas apparaissent chaque
année avec plus de 3 millions de décès annuels.
Essentiellement en Asie mais aussi en Afrique. Depuis 1980, le nombre
de cas dans les pays industrialisés augmente. En France on
estime l'incidence de la maladie à 17 cas pour 100.000
habitants. Une étude récente dont les grandes lignes
sont données dans un article de la Recherche d'avril 1999
(voir biblio en haut de cette page), cite une estimation de l'OMS de
90 millions de nouveaux cas entre 1990 et 2000. Les stratégies
à adopter sont discutées sans concession pour les
statistiques habituelles dont le degré de fiabilité
n'est pas toujours excellent. Le débat n'est certes pas
clos.
L'agent : C'est Koch qui, en 1882 a découvert le
bacille de la tuberculose (voir panorama historique).
On lui donne aussi le nom de bacille de Koch. C'est une
Mycobactérie . Ce groupe est composé de
bactéries allongées (bacilles) droit ou
incurvés, pouvant former de filaments parfois ramifiés
qui se fragmentent rapidement pour donner des bacilles. Elles ne se
développent que très lentement (temps d'incubation de
l'ordre de 40 jours pour former une colonie visible). La composition
de leur paroi (riche en acides gras complexes) permet de les colorer
spécifiquement (bactéries
acido-alcoolo-résistantes car la fuschine basique rouge ne
peut être enlevée de leur paroi par un traitement
à l'acide-alcool ; pour la petite histoire, et
pour relativiser une fois de plus le contenu scientifique des
encyclopédies, le dictionnaire Hachette multimédia les
présente comme des bactéries résistantes
à l'acide et à l'alcool à
90°C...!!!). Certaines mycobactéries sont
responsables de maladies du bétail et Mycobacterium
tuberculosis est l'agent principal de la tuberculose humaine.
L'autre maladie humaine importante due à des
mycobactéries est la lèpre, causée par
Mycobacterium leprae. Le séquençage du
génome complet de Mycobacterium tuberculosis a
été achevé en 1998.
Une première infection (ou primo-infection) passe
normalement inaperçue : le système immunitaire
fonctionne d'habitude correctement. La tuberculose primaire commence,
après l'entrée des bacilles dans l'appareil
respiratoire, par leur multiplication dans les alvéoles
pulmonaires. Certains bacilles se développent dans les
neutrophiles, les macrophages "accourus" lors de l'infection
(inflammation) et surtout les cellules dendritiques (cellules
du système réticulo-histiocytaire qui sont de la
même lignée que les macrophages - voir tableau
des cellules immunitaires) . Ces dernières peuvent migrer
vers les ganglions lymphatiques de l'appareil respiratoire
(trachéobronchiques).
Lors de la phase d'immunité innée
comme on appelle désormais volontiers la
première phase de l'activation du système immunitaire,
les mécanismes mis en jeu - que l'on pensait non
spécifiques - semblent plus diversifiés que le terme
général d'inflammation ne le laisse
supposer.
La mycobactérie de la tuberculose est
préférentiellement
phagocytée par les macrophages par au
moins trois mécanismes (La tuberculose, mythes
et réalités, Olivier Neyrolles et Brigitte Gicquel,
Pour La Science, 303, janvier 2003, 49):
* en présence des protéines du complément
activé (voir ci-après) il y a
phagocytose facilitée par opsonisation,
c'est-à-dire que les protéines du complément se
fixent sur la paroi bactérienne (fractions C3b et C3bi) et
facilitent ainsi l'adhérence du bacille avec les
récepteurs (dits CR) de la membrane du macrophage;
* lorsque le complément est inactif le bacille libère
lui-même une enzyme (C3-convertase) capable d'activer les
fractions du complément nécessaires à sont
opsonisation (C3b à partir de C2a);
* enfin, les résidus mannose (sucre) de la paroi de la
bactérie peuvent adhérer à des récepteurs
sépcifiques de la membrane du phagocyte (récepteurs
MR).
On a noté que les récepteurs CR et MR étaient
plus ou moins exprimés à des moments différents
de la maturation et de l'activation du macrophage, ce qui conduisait
le bacille à pouvoir pénétrer aussi facilement
dans des macrophages immatures que des macrophages
activés.
Ensuite, les bacilles phagocytés sont capables
d'empêcher (grâce à une pompe à protons au
niveau de leur membrane) le phagosome de perdre son acidité et
d'évoluer en phagolysosome où viennent se
déverser les enzymes lytiques (voir ci-dessus la
phagocytose). Il sont donc capables de
résister au sein de leurs vacuoles de
phagocytose.
Les bacilles pénètrent aussi dans les cellules
dendritiques grâce aux récepteurs CR et MR de ces
dernières. Mais d'autres récepteurs, spécifiques
des cellules dendritiques (DC-SIGN), semblent aussi intervenir en
reconnaissant des sucres spécifiques de la paroi de
Mycobacterium tuberculosis.
Les cellules dendritiques matures et les macrophages
sécrétent des cytokines, notamment
l'interleukine 12 en réponse à la stimulation de
récepteurs (TLR) dont on connaît des formes
différentes mais voisines chez de nombreux organismes,
notamment chez les insectes.
Remarque:
Afin de s'activer les unes les autres, les cellules dendritiques
peuvent communiquer entre elles en accolant leurs membranes mais on
connaît un autre système de communication entre cellules
dendritiques à l'aide de nanotubules creux (petits tubes
cytoplasmiques de quelques dizaines à quelques centaines de
nanomètres) Functional Connectivity between Immune Cells
Mediated by Tunneling Nanotubules, Simon C. Watkins and Russell
D. Salter, Immunity, Vol. 23, 309&endash;318,
September, 2005 (article EN ANGLAIS accessible sur internet à
l'adresse: http://www.microbio.uab.edu/CMIJournalClub/Oct10.pdf
et surtout les films et figures supplémentaires sont
accessibles à l'adresse: http://www.immunity.com/cgi/content/full/23/3/309/DC1/
); voir brève de Pour la Science, 338 (déc 2005),
20.
Dans les ganglions lymphatiques à lieu la
présentation des antigènes
tuberculeux par les cellules dendritiques infectées aux
lymphocytes T auxiliaires. C'est le point de
départ de la réponse immunitaire spécifique.
La contamination peut gagner, de là, l'ensemble du
système sanguin.
|
Présentation des
déterminants antigéniques par les macrophages*
aux lymphocytes T
|
|
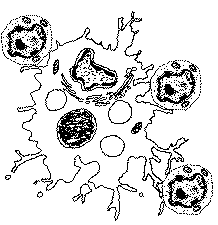
|
Dans les ganglions trachéobronchiques on observe
de nombreux contacts cellulaires entre les
macrophages et les lymphocytes T (schéma ci-contre).
Ces figures sont interprétées comme une
coopération cellulaire entre ces deux types de
cellules. Les macrophages infectés présentant
des fragments des protéines bactériennes
(fragments antigéniques ou déterminants
antigéniques) en association avec leur
molécules HLA (on parle, abusivement à mon
sens, de soi modifié). Les récepteurs T (rT)
et complexe CD3 des lymphocytes T effectuant alors une
double reconnaissance des molécules HLA et de
l'Ag. On parle d'activation ou de reconnaissance restreinte
au CMH car les molécules HLA sont indispensables
à la reconnaissance de l'Ag par les rT.
Les LT établissant ces contacts sont alors
activés. La plupart d'entre eux se
différencient en LT sécréteurs de
cytokines (LT auxiliaires ou LThelper), certains
en LT cytotoxiques (effecteurs). Ils se divisent
activement. Les LT auxiliaires stimulent la
dégradation des bactéries par les macrophages
infectés et la division des autres LT activés.
Les LT cytotoxiques peuvent lyser les macrophages ou
d'autres cellules infectées (selon un processus
décrit ci-après). On qualifie la
réponse de l'organisme de
réponse
immunitaire spécifique à médiation
cellulaire.
N.B.: on remarquera que, en accord
avec le programme et dans un souci de cohérence avec
les aspects développés plus haut sur le soi
moléculaire, je ne reprend pas à mon compte
les notions de clone immunocompétent,
sélection clonale ou encore expansion clonale
* dans le cas de la
tuberculose ce sont des cellules
dendritiques plutôt que des macrophages
qui sont les principales CpAg. Pour des raisons
pédagogiques, liées au programme, nous
conserverons le macrophage comme CpAg.
|
Attention à
l'échelle :
les molécules HLA et les rT ne
dépassent guère l'épaisseur de
la membrane plasmique des cellules...
pour un récepteur T de 7 nm de hauteur
extracellulaire (du même ordre de grandeur
que l'épaisseur de la membrane plasmique
classiquement de 8 nm), le diamètre du
lymphocyte T est de 8 µm soit 1000 fois plus
grand (et comme l'on comprend mieux avec des
exemples de taille plus grande : pour un lymphocyte
de diamètre relatif d'1 m, on aurait des rT
de 1 mm de hauteur... dessinez-les à
l'échelle et vous verrez...).
|
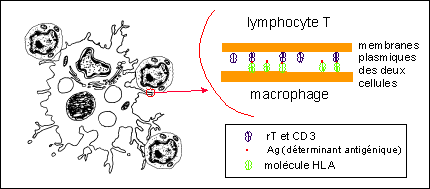
Contact entre un macrophage et des lymphocytes
T :
présentation des Ag en association avec les
molécules HLA du macrophage
|
Remarque: la zone de jonction
cellulaire entre une CpAg et un lymphocyte T a
été nommé récemment "synapse
immunologique" (au sens étymologique de "zone de
contact") par des chercheurs qui y ont découvert des
molécules qu'ils pensaient être
spécifiques de la jonction neuromusculaire
(voir "Les synapses jouent sur les
deux tableaux", Olivier Blond, La Recherche, 357,
octobre 2002, 14-15). On peut aussi
souligner la ressemblance morphologique entre de nombreuses
CpAg interdigitées et les neurones, sans oublier
cependant que celles-ci sont toutes issues de la
lignée myéloïde (voir TP),
embryologiquement différentes des cellules nerveuses
(issues de deux feuillets embryonnaires différents:
l'ectoblaste (neuroblaste) et le mésoblaste
(splanchnopleure)). Du point de vue fonctionnel les
différences semblent aussi très
marquées. Cependant le concept est attrayant en ce
qu'il réunit ce que je me suis efforcé de
présenter comme le système de communication
interne de l'organisme, immunitaire, et le système
nerveux, tourné vers l'extérieur (voir
bilan
plus loin).
|
|
Cytolyse par des LTcytotoxiques
ou effecteurs par contact membranaire
|
|
Les lymphocytes activés par les cellules
dendritiques présentatrices d'Ag migrent alors sur
les lieux de l'infection.
Les lymphocytes cytotoxiques impliqués ici
comportent le plus souvent les marqueurs membranaires CD4+
et plus rarement CD8+ (voir plus haut les remarques à
ce sujet : nous les désignons par leur fonction et
non par leurs marqueurs membranaires). Enfin, les cellules
cytotoxiques peuvent aussi être des
polynucléaires neutrophiles ou des cellules NK.
Lors de leur migration, les lymphocytes obéissent
à une attraction chimique (chimiotactisme) due
à des molécules qualifiées de
chimiokines et à leurs récepteurs peu
spécifiques situés sur les membranes des
cellules cibles. Actuellement on connaît 43
chimiokines et 17 récepteurs. Lors des
premières semaines qui suivent la contamination
des granulomes se forment ainsi par
agglomération de lymphocytes activés autour
des poches contenant des bactéries.
Si les bactéries sont en cours de multiplication
les lymphocytes T sécréteurs de
l'interféron gamma sont majoritaires. Ils
peuvent être porteurs des marqueurs CD4+ ou CD8+. Les
LT sécréteurs activeraient principalement les
macrophages qui, une fois stimulés, seraient capables
de détruire les bacilles qu'ils contiennent
grâce à des composés nitrés.
Si les bactéries sont en phase latente (voir plus
bas), les lymphocytes T actifs seraient surtout les
LTcytotoxiques qui se dirigeraient vers les
macrophages infectés (voir ci-dessous, le
schéma d'une lyse par contact).
(La tuberculose, mythes et
réalités, Olivier Neyrolles et Brigitte
Gicquel, Pour La Science, 303, janvier 2003, 51)
Lors de la lyse des cellules infectées (surtout
macrophages ici) ils peuvent ainsi contribuer à la
destruction des bactéries mais aussi à
leur dissémination, si elles résistent
aux enzymes lytiques. Enfin, certaines cellules cytotoxiques
peuvent lyser directement certaines bactéries
(Gram -). (Revillard, p213)
Remarque : le programme écarte volontairement de
nombreux autres mécanismes de lyse par d'autres
cellules, notamment par l'intermédiaire des Ac....
(Revillard ch 12-4 et 12-5)
|
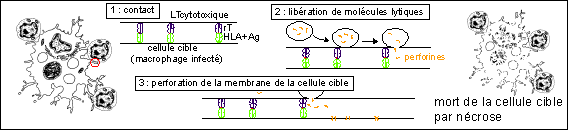
Une représentation très schématique
d'un mécanisme de lyse cellulaire par contact
entre un LT cytotoxique et un macrophage infecté et
libération de molécules perforantes
(perforines) provoquant la mort de la cellule cible
par nécrose en désorganisant la
membrane cellulaire par un mécanisme dépendant
du calcium. (voir Bordas p 127)
|
Remarque:
Certains lymphocytes différenciés regressent et
deviennent des LT mémoire susceptibles, en cas de
réactivation par présentation du même
déterminant antigénique qui les a stimulé, de se
différencier en lymphocytes effecteurs de la réponse
dite secondaire (dans ce cas les LTm peuvent aussi bien
sécréter des cytokines que des perforines) et de se
diviser très rapidement . Cette réponse secondaire plus
rapide, grâce à la présence de ces cellules
mémoire est à la base du rôle des vaccins (voir
ci-dessous). (cf. La cellule-mémoire,
gardien de l'immunité, Henrique Veiga-Fernandes, La
Recherche, 349, janvier 2002, 38-41)
Trois évolutions sont possibles :
* tuberculose disséminée, la plupart du temps
fatale ; la dissémination des cellules dendritiques
infectées se poursuit par le sang dans tout le corps. On voit
apparaître de petits tubercules contenant les bacilles
qui se multiplient activement. Ces cas peuvent être
détectés par une radiographie pulmonaire où l'on
observe des petits nodules tuberculeux au niveau des alvéoles.
Cette forme de la maladie n'apparaît que chez les enfants et
des personnes très affaiblies.
* tuberculose latente : c'est l'issue la plus
fréquente dans les pays industrialisés. Les personnes
infectées ne sont pas malades. Du point de vue clinique cette
phase correspond à une hypersensibilité cutanée
(test tuberculinique, voir ci-après) et l'on peut aussi
observer dans quelques cas (5%), sur des radios, de petits tubercules
pulmonaires qui n'évoluent pas. On ignore les
mécanismes de la latence mycobactérienne.
* tuberculose active : on observe une extension progressive
des tubercules pulmonaires avec une
dégénérescence des alvéoles pulmonaires
et des sinus (zone de confluence vasculaire) sanguins. Les personnes
sont alors contagieuses et la mort survient en absence de traitement.
Le diagnostic peut être fait par test cutané, par radio
pulmonaire ou par l'observation de crachats et la culture des
bacilles qu'ils contiennent.
Quelques données cliniques ou
épidémiologiques
(l'épidémiologie (du grec épi
= sur et demos = le peuple) est la science qui évalue
l'apparition et le suivi d'une maladie dans une population humaine
donnée):
Transmission: par voie aérienne lorsque les malades
toussent, éternuent ou même parlent.

|
L'éternuement non
réprimé...
les particules chargées de micro-organismes et
contenues dans l'aérosol sont constituées de
salive et de mucus. Les microgouttes (1
µm<Ø<4 µm) peuvent rester en
suspension plusieurs jours; les plus grosses gouttelettes
(Ø=10 µm) sont projetées à des
vitesses de 100 à 300 km/h mais s'évaporent
rapidement.
|
Cependant le nombre de bacilles présents dans les
expectorations varie beaucoup et moins de la moitié des
malades sont contagieux. La transmission vers l'homme à partir
d'espèces animales sensibles (bétail, chevaux, chats,
chiens) et de leurs produits (par exemple le lait) est possible ; ces
espèces peuvent aussi transmettre la forme animale M.
bovis.
Diagnostic : test tuberculinique: un dérivé
protéique purifié du bacille (tuberculine) est
injecté sous la peau et provoque, en cas de résultat
positif, l'apparition dans les 48h d'une induration et d'une rougeur
autour du site d'injection; chez un enfant, un test cutané
positif peut indiquer une tuberculose active ; chez un individu plus
âgé, il peut résulter d'une maladie
antérieure, d'une vaccination ou d'un test faussement positif
; ce test doit alors être complété par des
radiographies du thorax et la mise en évidence des nodules et
un isolement bactérien (isolement des bactéries
acido-alcoolo résistantes). On dispose aussi de sondes ADN
commercialisées.
Hypersensibilité : Ce résultat est du à
une hypersensibilité à médiation cellulaire (de
type IV). Une hypersensibilité est une réponse
immunitaire exagérée se manifestant après la
première exposition à un antigène et qui
endommage un tissu. L'hypersensibilité à
médiation cellulaire implique des cellules T
particulières : les cellules TDTH (delayed-type
hypersensitivity) qui prolifèrent après
sélection par les macrophages infectés
présentant l'antigène. Les cellules T activées
sécrètent alors des lymphokines qui attirent les
lymphocytes, les macrophages et les basophiles sur le lieu de
l'injection. Ces cellules provoquent des dommages tissulaires
importants (nécroses de type tubercule).
Thérapie: Avant la mise au point du traitement
antituberculeux, la moitié des patients mourait, un quart
était infecté de façon chronique et un quart
guérissait spontanément. Aujourd'hui, un traitement
bien conduit amène à la guérison de l'ensemble
des malades. On associe plusieurs antibiotiques pour éviter la
sélection de souches résistantes à tel ou tel
antibiotique (le risque d'apparition d'une multirésistance est
d'autant plus faible que le nombre d'antibiotiques utilisés
simultanément est grand).L'OMS recommande l'utilisation
d'isoniazide (INH), éthambutol, rifampicine et pyrazinamide
pendant deux mois. Ce traitement est long, doit être
continué alors que les symptômes ont disparu et n'est
pas dénué d'effets secondaires, ce qui conduit certains
patients à abandonner le traitement en cours et à
laisser se développer des souches résistantes qui se
propagent alors. Récemment des souches
multi-résistantes sont apparues et se répandent
rapidement, surtout dans des milieux défavorisés
américains des grandes villes par exemple étant
donné la faible prise en charge du traitement par
l'état (11% des malades hospitalisés à Harlem
finissaient leur traitement entre 1968 et 1988). L'état
américain a modifié sa politique depuis 1993 et l'on
observe un arrêt de l'augmentation des cas de tuberculose dans
ces milieux.
Vaccin : Un vaccin (le nom vient du latin
vacca=la vache ; il a été donné par Louis
Pasteur lors de ses travaux sur le choléra du poulet (~1880)
en hommage à Edward Jenner qui, de nombreuses années
avant (travail publié en 1798), s'était servi du
liquide provenant des pustules de la vaccine des vaches (maladie due
à un virus : le virus de la vaccine) pour protéger les
hommes de la variole) est un produit injecté (micro-organismes
tués, micro-organismes vivants mais atténués ou
encore toxines bactériennes inactivées ou anatoxines)
qui présente un pouvoir antigénique (immunité
artificielle acquise) sans présenter de pouvoir
pathogène. Pour la tuberculose, c'est le bacille de Calmette
et Guérin (BCG), qui est en fait le Mycobacterium
bovis atténué, agent de la tuberculose bovine (il
nécessite un rappel tous les 3-4 ans), qui est injecté
lors de la vaccination. Il permet de réduire le risque de
dissémination des bacilles de la tuberculose lors d'une
primo-infection. Toutefois, si le vaccin préserve le jeune
enfant contre les formes graves de la maladie comme les formes
méningées (qui atteignent les tissus protecteurs du
système nerveux central : les méninges), il ne
protège pas totalement l'adulte. D'autres pistes sont à
l'étude ; voir par exemple : Combattre
un vieil ennemi: la tuberculose , un article de Science
in school (http://www.scienceinschool.org/2007/issue7/tuberculosis/french/).
Récemment on a observé une recrudescence des cas de
tuberculose du fait de son association avec le SIDA. En effet, chez
les sujets séropositifs (contaminés et donc
partiellement immunodéprimés, c'est-à-dire dont
le système immunitaire est déficient) ayant eu une
primo-infection, les bacilles présents à l'état
dormant dans les tubercules anciens, peuvent se réactiver et
conduire rapidement à une tuberculose active fatale, et ce,
d'autant plus facilement, que les nodules ne sont pas souvent
détectables et que le seul symptôme est souvent une
fièvre prolongée, ce qui facilite la transmission du
bacille. La tuberculose représente aussi pour les
sidéens (malades en phase SIDA) une maladie opportuniste
dès la première infection. On utilise même
l'apparition de la tuberculose comme indicatrice du passage de la
séropositivité au SIDA maladie (11% des patients
séropositifs).
La tuberculose, de par sa recrudescence dans les pays
industrialisés, est redevenue un sujet de recherche de
nombreux laboratoires. Plusieurs nouveaux vaccins efficaces ont
été mis au point chez le souris. Mais le modèle
murin (le nom latin de la souris est Mus musculus) est assez
lointain de la tuberculose humaine (deux à quatre semaines
d'infection aigüe avec multiplication exponentielle du bacille,
suivie par une infection chronique stationnaire avec une charge
bactérienne très élevée). On
hésite donc à passer aux tests chez l'homme
(La tuberculose, mythes et
réalités, Olivier Neyrolles et Brigitte Gicquel,
Pour La Science, 303, janvier 2003, 53).
4.2 Des maladies virales : les infections à
herpès
Avertissement : comme pour la partie
précédente, le but de cette partie n'est pas une
étude d'une maladie mais une étude du
déroulement de la réponse immunitaire suite à
une contamination virale.
Les virus : les virus herpès (du grec
herpès = ramper) sont des assemblages
nucléo-protéiques à enveloppe : on trouve des
descriptions cliniques de l'herpès labial dans les
écrits d'Hippocrate (vers l'an 400 avant
Jésus-Christ).
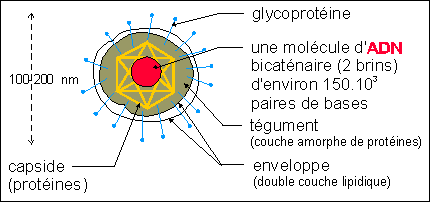
Structure schématique d'un virus de type herpès
Cinq virus herpès humains sur les 8 connus
en octobre 1995
(HHV6, 7 et 8 ont été
isolés respectivement en 1986, 1987 et
1994)
|
|
nom
|
cellules cibles
|
voie de transmission
|
pathologies
|
|
Herpes simplex type 1 : HSV-1 ou
HHV1
|
neurone
|
salive, contact direct entre l'épithélium
et le virus
|
herpès labial (boutons de fièvre...),
encéphalites
|
|
Herpes simplex type 2 : HSV2 ou HHV2
|
neurone
|
voie génitale, contact direct
|
herpès génital (fièvre,
brûlure, douleurs génitales avec petites
vésicules roses) pouvant être transmis à
l'enfant lors de l'accouchement (herpès
congénital pouvant entraîner des complications
neurologiques et même la mort)
|
|
virus varicella zoster : VZV ou HHV3
|
neurone
|
inhalation, contact direct
|
varicelle, zona (forme récurrente de la
varicelle)
|
|
virus d'Epstein-Barr : EBV ou HHV4
|
lymphocyte B
|
salive, sang
|
mononucléose infectieuse
|
|
Herpès associé au sarcome de Kaposi :
KSHV ou HHV8
|
lymphocyte ?
|
?
|
Sarcome de Kaposi
(on ne sait pas si l'HHV8 est l'agent du
sarcome ...)
|
Les virus de type herpès font partie des virus peu
cytopathogènes (qui détruisent peu les cellules de
l'organisme ; à l'inverse du virus de la grippe, très
cytopathogène) qui peuvent persister dans l'hôte pendant
de longues périodes (souvent toute la vie) et qui causent des
formes très variées de maladies selon les
défenses immunitaires des individus. Classiquement voici
l'évolution d'une maladie à herpès :
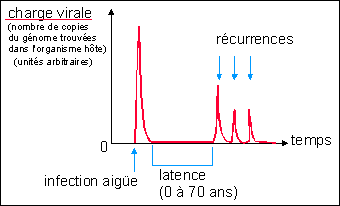
Évolution classique d'une infection à virus
herpès
Remarque : la plupart des infections virales ne provoquent
aucun signe visible ou correspondent à des maladies
bénignes (légère fièvre par exemple).
L'issue d'une maladie virale dépend de facteurs liés au
virus (cytopathogénie, moyens de contourner le système
immunitaire...) mais surtout de l'état du système
immunitaire de l'hôte. Dans le cas d'un virus herpès la
première infection est souvent inapparente (aucun signe
clinique visible), puis le virus se localise dans les neurones
sensitifs. Une réactivation peut avoir lieu très
longtemps après à l'occasion d'un stress, d'une
irradiation u.v. ou d'un déficit immunitaire (SIDA par
exemple).
Contamination et pathogénie: La transmission se fait
par contact direct entre les tissus épithéliaux des
lèvres et le virus ou par la salive. Une ampoule
apparaît au site d'entrée du virus (inoculation), le
plus souvent sur les lèvres ou sur les muqueuses de la bouche
ou encore sur les gencives. Ces vésicules, issues de la
dégradation des cellules épithéliales par le
virus, guérissent habituellement en moins d'une semaine.
Pendant ce temps le virus migre vers le ganglion du nerf trijumeau
où il persiste à l'état latent pendant toute la
vie de la personne infectée. Des infection récurrentes
(réactivation) peuvent apparaître à la suite d'un
stress ou de changements hormonaux. Le virus migre à nouveau
du ganglion vers la commissure des lèvres le long des nerf
périphériques et provoque l'apparition d'un bouton de
fièvre. Il peut aussi provoquer des inflammations de la
cornée (kératite herpétique qui provoque de
nombreuses cécités). On pense que près de 70
à 90% de la population adulte est infectée par le virus
HHV1 car ils possèdent des anticorps spécifiques.
Immunité non spécifique : L'entrée du
virus se fait par des récepteurs spécifiques à
la surface des cellules épithéliales. Il y a une grande
spécificité d'hôte : seules les cellules
présentant ces récepteurs sont susceptibles
d'être infectées. Le virus, est ensuite
répliqué par la cellule hôte qui, la plupart du
temps finit par en mourir, mais non sans avoir présenté
des fragments de peptides viraux qu'elle synthétise en
association avec ses molécules HLA. Les mécanisme de
l'inflammation connus qui luttent contre la propagation d'un virus
reposent essentiellement sur un groupe de substances antivirales
sécrétées par les globules blancs, les
lymphocytes T activés et les cellules NK : ce sont les
interférons. Ces molécules bloquent la
traduction des protéines virales dans les cellules hôtes
et stimulent la synthèse des molécules HLA
présentant les peptides viraux au système immunitaire.
Les interférons stimulent aussi la lyse directe par les
cellules NK des cellules infectées par les virus.
Réponse immunitaire T spécifique : les
cellules infectées présentent des peptides viraux en
association avec leurs molécules de classe I et II
simultanément ce qui permet une co-activation des
lymphocytes T auxiliaires et T cytotoxiques reconnaissant les
peptides viraux en association avec l'une ou l'autre classe de
molécules HLA. (Les T auxiliaires impliquées dans cette
réponse anti-virale possèdent essentiellement le CD4+
et les T cytotoxiques le CD8+). Les T cytotoxiques (que l'on peut
dans ce cas nommer LT8) sont activés SIMULTANEMENT par
reconnaissance du peptide viral associé aux molécules
HLA de la cellule infectée ET par des cytokines produites par
les lymphocytes T auxiliaires effectuant le même type de double
reconnaissance à partir des peptides viraux
présentés en association avec les molécules HLA
de la cellule infectée (que l'on peut nommer dans ce cas LT4).
La cytokine principale mise en évidence dans cette activation
est l'IL-2 (interleukine 2), produite par les LT activés. (On
pense que, à la suite du contact CpAg-LT, le LT exprime les
gènes de l'IL-2 , de certaines moléculaires
membranaires dont les récepteurs à l'IL-2. La fixation
de l'IL-2 aux récepteurs de la cellule qui la produite
l'autostimule et déclenche notamment la division
cellulaire...L'IL-2 est considérée comme une
hormone car elle est transportée par la circulation
sanguine et active les cellules NK, les lymphocytes B ; à
forte dose est déclenche dune fièvre, une hypotension,
et de graves modifications physiologiques....).
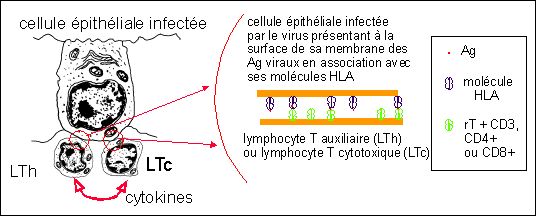
Co-activation des LTauxiliaires (LT helpers =
LTh) et des LT cytotoxiques (LTc)
en contact avec une cellule épithéliale
infectée (jouant le rôle de cellule
présentatrice d'Ag)
Les LT cytotoxiques (LT8 ici) activés réalisent ensuite
la phase effectrice : ils lysent les cellules infectées par le
virus... (voir plus haut, mécanisme identique avec
libération de perforines après contact membranaire avec
la cellule cible qui est ici une cellule infectée). Vous
noterez qu'il n'y a pas besoin de déplacement des LTc qui sont
déjà en contact avec leur cellule cible.
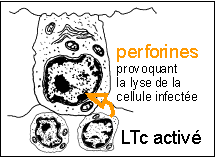
Phase effectrice :
cytolyse des cellules infectées par le virus grâce
à la libération de perforines
(ou d'autres substances cytolytiques) par les LTc activés
(dans ce cas des LT8)
Réponse immunitaire Ac spécifique : les
lymphocytes T auxiliaires activés selon le processus
décrit ci-dessus migrent aussi dans les ganglions
lymphatiques voisins où ils stimulent les lymphocytes B
selon un principe de coopération cellulaire faisant
intervenir des contacts membranaires entre LTh et LB grâce aux
rT des uns et aux molécules HLA et mIg des autres. Cette
coopération met aussi en jeu des cytokines
sécrétées par les LTh activés.
Simultanément de petits fragments d'Ag viraux
(épitopes) peuvent être reconnus directement par les mIg
de LB qui internalisent alors les complexe Ag-mIg et jouent alors le
rôle de cellule présentatrice d'Ag pour des lymphocytes
T qui sont alors activés. La part de ces différents
mécanismes est loin d'être connue avec précision
dans le cas d'une infection virale à herpès. Il nous
suffit de savoir qu'ils peuvent avoir lieu. En tout cas il est
indubitable qu'il y a production d'Ac spécifiques
dirigés contre certains petits fragments polypeptidiques du
virus au pouvoir antigénique (épitopes).
|
Réponse
immunitaire à médiation
humorale
|
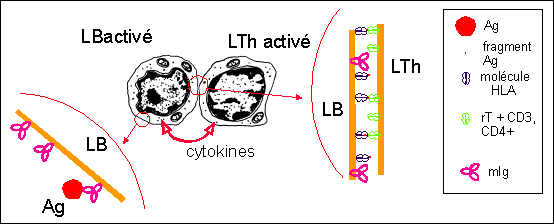
Coopération cellulaire LB-LTh
entre lymphocyte B (LB pouvant être
activé directement par reconnaissance de l'Ag par ses
Ig membranaires = mIg) et lymphocytes T auxiliaire
(LThelpers = LTh) : ici c'est soit le LB qui, activé
par l'Ag stimule le LTh qui devient activé et stimule
en retour le LB ; soit c'est le LTh qui a été
activé lors de mécanismes de
coopération LTh-LTc par contact avec une cellule
infectée (voir plus haut) et qui active à son
tour le LB : ce dernier mécanisme se passe dans le
cortex superficiel des ganglions
lymphatiques.
|
|
Les LB activés prolifèrent alors dans le
cortex superficiel ganglionnaire (on les nomme alors
lymphoblastes) ; certains se différencient
(irréversiblement) en plasmocytes
sécréteurs d'Ac (mais ils perdent leurs
mIg) et ont une durée de vie courte (quelques jours
à quelques semaines tout au plus, selon le type d'Ig
qu'ils sécrètent). Ils migrent vers la zone
médullaire du ganglion lymphatique et vers les
tissus; d'autres évoluent en lymphocytes B
à mémoire de petite taille qui restent
dans le cortex ganglionnaire.
|
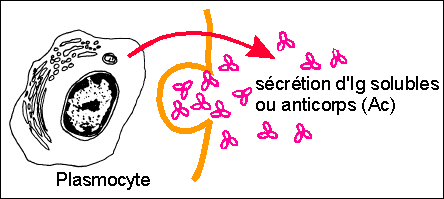
Sécrétion d'Ig solubles
(Ac) par un plasmocyte
différencié
Chaque plasmocyte ne sécrète qu'un seul type
d'Ac plus ou moins spécifique d'un Ag. Les
plasmocytes sont considérés comme des usines
à Ac : on estime qu'ils sécrètent
jusqu'à 2.000 molécules d'Ac à la
seconde
|
|
Les Ac réalisent la réponse immunitaire
à médiation humorale par
différentes activités selon la partie de la
molécule impliquée (vois schéma d'une
Ig ci-dessus):
- à l'extrémité des deux bras de
l'Y que forme la molécule d'Ig il y a deux
sites antigéniques identiques dont le grand
polymorphisme de séquence des aa qui le composent
permettent une liaison spécifique avec un
Ag. La fixation d'une ou plusieurs molécules
d'Ac à un Ag forme un complexe immun
 qui, dans le cas d'une toxine ou d'un virus de petite
taille, permet de neutraliser l'Ag,
c'est-à-dire qu'il empêche le pouvoir
pathogène de s'exprimer (par encombrement spatial
par exemple dans le cas d'une toxine ou par
empêchement d'un virus à se fixer aux
récepteurs membranaires qui lui permettent de
pénétrer dans une cellule hôte). Les
complexes immuns sont ensuite phagocytés par les
neutrophiles ou les macrophages, notamment grâce
à la deuxième partie de la molécule
d'Ac :
qui, dans le cas d'une toxine ou d'un virus de petite
taille, permet de neutraliser l'Ag,
c'est-à-dire qu'il empêche le pouvoir
pathogène de s'exprimer (par encombrement spatial
par exemple dans le cas d'une toxine ou par
empêchement d'un virus à se fixer aux
récepteurs membranaires qui lui permettent de
pénétrer dans une cellule hôte). Les
complexes immuns sont ensuite phagocytés par les
neutrophiles ou les macrophages, notamment grâce
à la deuxième partie de la molécule
d'Ac :
- la partie verticale de l'Y que forme la
molécule d'Ac est une partie de séquence
peu variable (dite partie commune à tous les Ac)
qui intervient dans deux rôles :
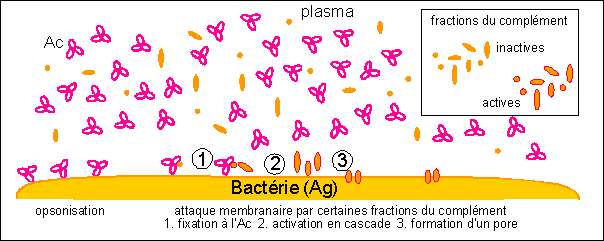
Deux rôles essentiels des Ac :
opsonisation (recouvrement des Ag afin de faciliter
leur phagocytose)
et
activation du complexe d'attaque membranaire
(appartenant au complément).
Ainsi les opsonines dont nous avons parlé
lors de la phagocytose sont des éléments qui
se fixent sur l'Ag et favorisent la phagocytose. On a donc
deux grand groupes de molécules opsonisantes :
d'une part les Ac qui se fixent sur l'Ag et favorisent la
phagocytose par des récepteurs de la membrane de
phagocytes à la partie constante des Ac ; d'autre
part les fractions du complément qui se fixent sur
ces Ag (recouvrent leur surface), les neutralisent, attirent
les phagocytes et enfin favorisent la phagocytose
(éléments de la voie alterne). Une
phagocytose avec opsonisation est donc une
phagocytose favorisée soit par des molécules
spécifiques de l'Ag (Ac) soit non spécifiques
(fractions opsonisantes du complément).
|
|
Remarque 1: étant donné que les
différentes classes d'Ig ne sont pas au programme de
TS, ni l'origine génétique de leur
diversité, il est évident que les
mécanismes indiqués plus haut sont très
approximativement décrits et ne rendent
malheureusement pas du tout compte des concepts qui
recouvrent la notion actuelle d'Ac et ses rôles dans
la réponse immunitaire.
Remarque 2 : Le complément n'est pas au
programme en tant que tel et il ne doit être
envisagé que comme un élément
associé aux Ac. Cependant, d'un point de vue plus
général, il me semble intéressant de
préciser quels sont les éléments
plasmatiques participants à la défense de
l'organisme : le complément ne représentant
que 5% des protéines plasmatiques. Les trois autres
systèmes reconnus sont : les systèmes de
coagulation (composé de protéines dont la
principale est le fibrinogène, associé aux
plaquettes pour former le caillot), le système de
contact (ensemble de protéines, parmi lesquelles
on peut citer le facteur Hageman, qui interviennent dans
l'inflammation notamment) et le système de la
fibrinolyse (qui permet la destruction d'un caillot
sanguin). Tous ces systèmes de protéines
plasmatiques sont bien sûrs reliés entre eux et
coordonnés.
|
Remarques: comme la plupart des infections virales, les
infections herpétiques provoquent une très forte
sécrétion d'Ac spécifiques dont la
synthèse se poursuit très longtemps (parfois pendant
toute la vie). Mais les mécanismes de cette permanence sont
inconnus (Revillard p 202). Étant donné la faible
durée de vie des plasmocytes, on pense qu'il doit y avoir un
système de présentation des Ag permanent. Mais on peut
aussi faire appel à la théorie actuelle concernant les
lymphocytes T mémoire. Ces LTm, issus du clone de LT
différenciés à la suite de la réponse
immunitaire T spécifique, formeraient une population de
cellules capables de se différencier rapidement (environ 10 h,
donc 3 fois plus vite que les cellules naïves) lors de la
deuxième présentation du déterminant
antigénique (réponse secondaire) et présenter
alors plusieurs fonctions en même temps:
sécréteurs de cytokines et de perforines. Ils
n'auraient pas besoin d'être stimulés de façon
permanente par un Ag et formeraient une population de cellules
à très longue durée de vie. (cf.
La cellule-mémoire, gardien de l'immunité,
Henrique Veiga-Fernandes, La Recherche, 349, janvier 2002, 38-41)
L'acyclovir est un des premiers
médicaments antiviraux à la fois efficace et peu
toxique à avoir été découvert: c'est un
analogue de nucléoside (élément des acides
nucléiques composé d'une base et d'un sucre) capable
d'empêcher la réplication de Herpes simplex.
L'AZT (zidovudine) efficace contre le VIH est aussi un analogue de
nucléoside. Ces composés inhibent les étapes de
synthèse d'ADN viral dans la cellule infectée
(transcription inverse dans le cas de l'AZT: passage de la
molécule d'ARN du virus à une molécule d'ADN,
réplicable). Mais les antiviraux peuvent aussi être
dirigés contre l'entrée du virus dans la cellule
hôte, la synthèse des protéines du virion ou
encore la dissémination des particules virales
(pour des données récentes voir par exemple: Les
nouveaux antiviraux, William Haseltine, Pour la
Science, 291, janvier 2002, 52-59).
5. L'homme sain
En conclusion, je suis conscient de présenter aux
élèves une vision du système immunitaire un peu
différente de celle présentée dans les manuels
scolaires, mais elle sera, à mon avis, plus féconde. Le
système immunitaire me semble devoir être
regardé, ainsi qu'on le fait habituellement pour un autre
appareil (digestif par exemple), comme un ensemble d'organes,
eux-mêmes composés de différents tissus et
réalisant une même fonction : la défense de
l'organisme. Si l'on se
réfère par exemple à un excellent article de
Michel Fougereau (La reconnaissance imunitaire, La Recherche,
suplément médecine, 237, novembre 1991, pp 4-10), les
concepts que je présente font peut-être figure
d'idées rétrogrades. Je ne le pense pas. Si, pour un
immunologiste moderne, qui a acquis de grandes compétences en
anatomie, en histologie et en physiologie, il n'y a pas de danger
à s'investir dans des mécanismes moléculaires,
je pense par contre que, dans l'étape de formation des
élèves de terminale, il est indispensable de reprendre
ces bases plus générales sous peine de ne plus rien
comprendre à l'organisme humain.
(Il est incohérent de
vouloir présenter le soi moléculaire sans parler de
l'allotypie, de l'isoptypie et de l'idiotypie et donc sans parler
aussi de l'origine de la diversité des Ac, notions qui ne sont
pas au programme).
L'origine unique des cellules souches et la colonisation par
celles-ci de certains organes en est un point essentiel. Il me semble
que la connaissance du système immunitaire chez l'adulte passe
par celle de sa mise en place pendant la période fœtale.
C'est encore l'embryologie qui se présente comme un domaine
d'avenir de l'immunologie. Les cellules embryonnaires qui vont
devenir les cellules immunitaires fonctionnelles doivent pour cela
se différencier : c'est-à-dire acquérir
leur immunocompétence. Ce qui détermine la
compétence d'un tissu (ici le système immunitaire)
est essentiellement son histoire, sa mémoire (c'est
à ce titre que l'histoire individuelle est essentielle pour
comprendre la variabilité de réponse en face d'une
agression). L'expression de certains récepteurs est sans aucun
doute un aspect des choses mais n'est certainement pas le seul. Il
existe des déterminants cytoplasmiques de la
différentiation qui font que telle cellule est
compétente et que telle autre ne l'est pas (c'est encore vers
des études d'embryologie expérimentale que je me tourne
comme celles de Rosine Chandebois).
Deuxième point essentiel pour le système
immunitaire, étant donné la dispersion des cellules qui
composent le tissu immunitaire : les relations entre les cellules.
C'est peut-être ce qui est le plus évident actuellement
: le système immunitaire se présente comme un vaste
réseau de communication entre cellules par
l'intermédiaires de substances chimiques solubles
(essentiellement des cytokines : substances
sécrétées par des cellules en réponse
à un signal spécifique; mais aussi des hormones
: substances dont le taux est régulé) et de
molécules membranaires permettant des contacts entre
cellules (récepteurs à d'autres molécules
membranaires ou à des molécules solubles). Ce
système de communication présente trois aspects sur
lesquels je souhaite insister : d'une part il est dynamique
(toujours en mouvement) et d'autre part coordonné,
enfin il est évolutif. Le dynamisme du système
est essentiellement du aux deux appareils circulatoires sanguins et
lymphatiques, mais aussi au fait que le système immunitaire
est composé de cellules souvent isolées et capables de
se déplacer activement et de changer de compartiment. La
coordination de la réponse se fait plus, à mon sens,
par la localisation des zones de contact entre cellules (contact
membranaire ou par l'intermédiaire de cytokines à
faible rayon d'action) que sont les organes lymphoïdes
secondaires, que par des substances régulatrices. A ce sujet
je citerai par exemple Revillard (p 301): "Il est essentiel de mieux
connaître les mécanismes des réponses
immunitaires locales au niveau des voies génitales si
l'on veut mettre au point des vaccins contre les maladies
sexuellement transmissibles" ; cet aspect de la réponse
immunitaire me semble essentiel : la réponse immunitaire
est locale, elle n'est pas la même selon le point de
pénétration de l'Ag : il est connu qu'un Ag peut
provoquer une réaction immunitaire très grave s'il est
injecté, alors que sa prise orale (par la bouche)
régulière peut conduire à l'absence de
réaction à la suite d'une injection postérieure.
Il y a donc une souplesse, une adaptation du système
immunitaire qui peut aussi être formulée par le terme
d'évolution. L'évolution du système immunitaire
regroupe ainsi les différentes étapes de sa mise en
place, la prise en compte de l'histoire individuelle, et surtout, la
possibilité pour l'homme de le modifier à l'aide de
vaccins, de sérums, de transplantations et autres applications
médicales. La médecine est un art qui applique
directement les connaissances de la science immunologique, mais elle
participe aussi à l'acquisition de ces connaissances et en ce
sens elle est aussi une science.
1 . A la recherche de l'identité de
l'homme ; 2 . L'homme, milieu de vie
;
3 . L'homme blessé ; 4 . L'homme
malade; 5 . L'homme sain
TP: le système immunitaire: des
cellules et des organes -
TD: retour sur les cellules et les
molécules du système immunitaire
retour sommaire cours Terminale
S












 qui, dans le cas d'une toxine ou d'un virus de petite
taille, permet de neutraliser l'Ag,
c'est-à-dire qu'il empêche le pouvoir
pathogène de s'exprimer (par encombrement spatial
par exemple dans le cas d'une toxine ou par
empêchement d'un virus à se fixer aux
récepteurs membranaires qui lui permettent de
pénétrer dans une cellule hôte). Les
complexes immuns sont ensuite phagocytés par les
neutrophiles ou les macrophages, notamment grâce
à la deuxième partie de la molécule
d'Ac :
qui, dans le cas d'une toxine ou d'un virus de petite
taille, permet de neutraliser l'Ag,
c'est-à-dire qu'il empêche le pouvoir
pathogène de s'exprimer (par encombrement spatial
par exemple dans le cas d'une toxine ou par
empêchement d'un virus à se fixer aux
récepteurs membranaires qui lui permettent de
pénétrer dans une cellule hôte). Les
complexes immuns sont ensuite phagocytés par les
neutrophiles ou les macrophages, notamment grâce
à la deuxième partie de la molécule
d'Ac :
