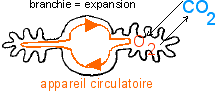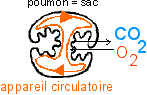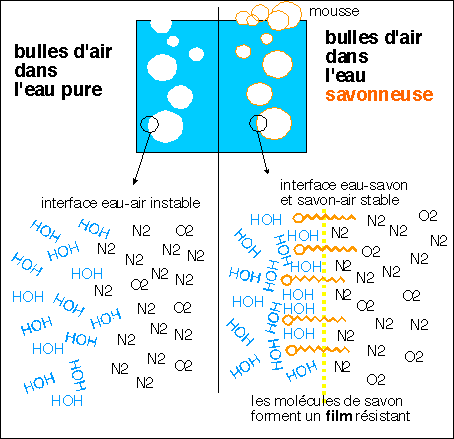dans l'air du temps (annexes)
retour à la page principale sur
l'air
composition de
l'air
au niveau de la basse atmosphère (en % de la masse
totale de l'air; in Encyclopedia Universalis et
Schmidt-Nielson)
|
gaz à concentration fixe
|
gaz à concentration facilement
fluctuante
|
|
azote
|
78,09
|
dioxyde de carbone
|
0,03
|
|
oxygène
|
20,95
|
hydrogène (devient majoritaire dans la haute
atmosphère)
|
|
argon
|
0,8340
|
0,93
|
hydrogène sulfuré, ammoniac, méthane
et autres résidus de fermentations
|
|
néon
|
0,001818
|
monoxyde de carbone (en ville) et anhydride sulfureux et
autres résidus de combustions
|
|
hélium
|
0,000624
|
|
krypton
|
0,000114
|
protoxyde d'azote et ozone dans la haute
atmosphère
|
|
xénon
|
0,0000067
|
|
radon
|
0,000000000000000006
|
vapeur d'eau
|
|
autres composants retirés de l'air
par filtration avant des mesures de composition:
poussières (industrielles, volcaniques, biologiques:
spores, pollen...), cristaux de chlorure de sodium (sel) au
voisinage des mers...(pensez aux problèmes de
corrosion sur nos bords de mer...)
|
retour haut de page
air
(élément): un
peu d'histoire des sciences (in Encyclopedia Universalis, article
"air, élément" de Georges Kayas et "air" de Jean
Perrotey)
Anaximène (~ 556-~ 480), à la différence
de Thalès, enseignait que toute substance provient de l'air
(pneuma ) par raréfaction et condensation;
dilaté à l'extrême, cet air devient feu;
comprimé, il se transforme en vent; il produit des nuages, qui
donnent de l'eau lorsqu'ils sont comprimés. Une compression
plus forte de l'eau transforme celle-ci en terre, dont la forme la
plus condensée est la pierre. Empédocle a
considéré trois autres éléments comme
fondamentaux: le feu, l'eau et la terre, et Platon a donné une
interprétation géométrique des quatre
éléments dans laquelle l'air est
représenté par l'octaèdre régulier.
La théorie des quatre éléments a
été transmise jusqu'au XVIIIe siècle par les
philosophes et les alchimistes (tetrasomia ); mais Jan
Baptist Van Helmont (1577-1664), mi-chimiste, mi-alchimiste,
est amené à considérer qu'il y a plusieurs
espèces de «fluides élastiques», auxquels il
a donné le nom de gaz (du mot flamand
ghoast ). Toute une «science des gaz» ou
«pneumatique» s'est développée pendant le
XVIIe siècle avec Torricelli (1608-1647), Pascal
(1623-1662), Otto von Guericke (1602-1686), R. Boyle
(1627-1691), E. Mariotte (1620-1684) et d'autres. «On
n'aurait jamais pensé à cet élément,
écrit le célèbre chimiste Boerhaave, si l'on
n'avait pas observé la résistance qu'il offre au
mouvement des corps présentant un grand volume [...].
C'est donc un fluide résistant au mouvement, mais qu'il est
difficile de connaître parfaitement, car, à cause de sa
subtilité, il n'affecte que très peu nos
organes.» L'air est donc considéré comme un
fluide subtil contenant beaucoup de corpuscules d'espèces
différentes et hétérogènes. Il semble
même contenir de l'or! Il pénètre les pores de
tous les solides sans «se coaguler» avec eux; il
suffit de «détruire les prisons où il est
retenu» pour qu'il en ressorte sans avoir subi aucun
changement. Au milieu du XVIIIe siècle, Buffon écrivait
encore: «Nous ignorons actuellement quelle est la figure des
parties constituantes des corps; l'eau, l'air, la terre, les
métaux, toutes les matières homogènes sont
certainement composées de parties élémentaires
semblables entre elles, mais dont la forme est inconnue.»
Dans son livre Vegetable Staticks , Stephen Hales ne rapporte
pas moins de cent vingt-quatre expériences sur l'air et les
fluides et montre que les propriétés physiologiques de
l'air sont variables suivant les cas, bien qu'il obéisse
toujours à la loi de Boyle-Mariotte; il considère donc
que l'air existe sous deux formes différentes: l'«air
élastique» et l'«air fixe», ou
«air permanent». Pour la première fois, on
commence à recueillir l'air dans des flacons pleins d'eau
renversés sur une cuve à eau (on utilisera ensuite le
mercure), mais ce n'est qu'en 1753 que Joseph Black
(1728-1799) démontre que l'air fixe de Hales n'a pas les
mêmes propriétés que l'air ordinaire et qu'il est
identique au «gaz Silvestris» de Van Helmont,
c'est-à-dire à notre dioxyde de carbone (CO2),
libéré pendant les fermentations. Mais la chimie des
gaz est difficile; et, quand Scheele (1742-1786) et
Priestley (1733-1804) préparent, peu avant Lavoisier,
l'«air du feu», ils pensent qu'il s'agit d'une combinaison
de phlogistique et d'eau; de même, en préparant
l'oxygène par calcination de l'oxyde de mercure, Priestley
pense avoir isolé l'«air
déphlogistiqué» (protoxyde d'azote), tandis que
l'«air phlogistiqué» (notre azote),
dégagé pendant la combustion, ne peut entretenir le
feu. À cet air déphlogistiqué
«éminemment respirable» Lavoisier a donné le
nom d'oxygène, pensant qu'il était le constituant de
tous les acides. Lorsque Cavendish (1731-1810) isola
l'hydrogène, il crut avoir identifié le
phlogistique.Scheele reconnut que l'air n'est pas un
élément simple, mais un composé de deux gaz.
Phlogistique vient d'un adjectif grec (phlogiston) signifiant
«inflammable» utilisé pour la première fois
par Aristote pour désigner une combustion accompagnée
de flamme; il fut ensuite repris par Becher (1635-1682) et surtout
par Stahl (1660-1734) pour désigner l'un des
éléments des corps composés: Becher pensait que
tous les corps composés contiennent, en proportions
différentes, trois espèces de terre: la terre
vitrifiable, la terre sulfureuse ou inflammable (le pohlogistique) et
la terre mercurielle. Cette théorie du phlogistique
régna sur la chimie des gaz pendant un demi-siècle (on
pensait alors que le phlogistique était plus léger que
l'air, puis on essaya de lui attribuer un poids négatif).
C'est Lavoisier qui dans son mémoire
célèbre intitulé Réflexions sur le
phlogistique (1785) porta le coup de grâce à la
théorie. En effet, Lavoisier refit l'expérience de
Priestley, qui de passage à Paris en octobre 1774, lui avait
annoncé qu'en chauffant sur une cuve à mercure le
précipité per se (oxyde mercurique rouge),
au moyen des rayons solaires concentrés par une forte
lentille, qu'il venait d'obtenir ce qu'il appelait
l'« air déphlogistiqué».Lavoisier
fut le premier à comprendre que l'air privé de
phlogistique était en réalité un «air»
particulier. Il venait de découvrir que l'air de
l'atmosphère était un mélange de deux gaz
différents: l'air vital (l'oxygène) et la
mofette (l'azote), le phlogistique n'ayant rien
à voir dans sa composition.
L'expérience par laquelle il établit la composition
de l'air est, encore à notre époque, un
modèle de rigueur scientifique et de raisonnement
déductif. Dans un dispositif constitué par une
cornue à long col recourbé contenant du
mercure, et une cloche reposant sur un bain de mercure, une
quantité déterminée d'air est enfermée.
Le niveau est soigneusement repéré sur la cloche
«avec une bande de papier collé». Le mercure est
alors porté à ébullition; il ne se passe rien le
premier jour. Des «parcelles rouges» apparaissent à
la surface du mercure le deuxième jour et s'accroissent
jusqu'au sixième. Pour s'assurer de la fin de la
réaction, Lavoisier poursuit l'ébullition du mercure
six autres jours, puis, après refroidissement, correction de
température et de pression, le volume d'air résiduel
est mesuré: il a diminué de 1/6 environ. Lavoisier
étudie alors le résidu gazeux obtenu: «Les
animaux qu'on y introduisait y périssaient en peu d'instants
et les lumières s'y éteignaient sur-le-champ comme si
on les eût plongées dans de l'eau.» La
matière rouge recueillie à la surface du mercure est
étudiée par ailleurs. Par calcination, il se
dégage «un fluide élastique beaucoup plus
propre que l'air de l'atmosphère à entretenir la
combustion et la respiration des animaux». Les conclusions
de Lavoisier sont d'une rigueur et d'une clarté qui forcent
l'admiration si l'on tient compte des conditions matérielles
de ses expériences: «L'air de l'atmosphère est
composé de deux fluides élastiques de nature
différente et pour ainsi dire opposée.»
Après l'analyse et l'étude des parties, Lavoisier
procède à la synthèse: «en recombinant
les deux fluides élastiques obtenus séparément,
c'est-à-dire 42 pouces cubiques de mofette ou air non
respirable et 8 pouces cubiques d'air respirable, on reforme de l'air
en tout point semblable à celui de
l'atmosphère». Les résultats des analyses de
Lavoisier le conduisent à penser que l'air
atmosphérique contient 27 p. 100 d'oxygène, alors que
la teneur réelle n'est que de 21 p. 100.
Des expériences ultérieures lui permirent
d'établir le rôle de l'air vital dans la formation de
l'acide phosphorique et de l'acide sulfurique, ce qui l'amena
à lui donner en 1779 le nom de principe oxigine ,
qu'il écrira plus tard principe oxigène
(du latin oxus = acide), au sens de principe
acidifiant.
Mais Lavoisier apporta aussi sa contribution dans la
compréhension de la respiration animale. Lorsque, en
1776, il avait repris les expériences sur les faits
signalés par Priestley, Lavoisier avait constaté
à son tour que l'air privé d'oxygène par
l'oxydation du mercure était devenu aussi méphitique
(qui dégage une odeur infecte ou toxique) que l'air
altéré par la respiration d'un moineau et dont il avait
absorbé l'acide carbonique par la potasse. Après avoir
reconstitué l'air primitif en ajoutant l'oxygène
disparu à la première mofette provenant de l'oxydation
du mercure et à la seconde mofette provenant de la respiration
animale, il avait constaté que dans les deux cas cet air
permettait aussi bien d'entretenir la combustion que la vie animale.
Les relations entre l'air, l'oxygène et l'acide carbonique
dans la respiration étant établies, restaient à
comprendre l'action de l'oxygène sur l'être vivant et
l'origine de l'acide carbonique. L'analogie avec la couleur des
oxydes de mercure et de plomb amena Lavoisier à attribuer la
coloration rouge du sang artériel à l'absorption
d'oxygène. Il compara la chaleur animale à celle des
combustions vives, estimant que l'air fournissait l'oxygène et
la chaleur, tandis que le sang véhiculait le combustible,
restitué incessamment par les aliments. En 1783, il reprit la
question avec Laplace. Tous deux mesurèrent les effets
de la respiration d'un cochon d'Inde, qu'ils comparèrent
à la combustion d'une bougie, en utilisant une balance et un
calorimètre. «Lorsqu'un animal est dans un état
permanent et tranquille, de telle sorte qu'après plusieurs
heures le système animal n'éprouve point de variation
sensible, la conservation de la chaleur animale est due au moins en
grande partie, conclurent-ils, à la chaleur que produit la
combinaison de l'oxygène respiré avec la base de l'air
fixe que le sang lui fournit.» La respiration, signala
Lavoisier, est l'origine d'une combustion lente, analogue à
celle du charbon. À partir de 1789, il poursuivit avec son
élève, Armand Seguin, l'étude de la respiration
et de la transpiration. Dans le prix sur la nutrition proposé
en 1793 par l'Académie des sciences, il dressa un programme de
recherches sur la chimie physiologique en demandant l'étude
des fonctions du foie.
La première mise en évidence des gaz rares de l'air est
attribué à Cavendish en 1790. La composition exacte de
l'air ne sera établie qu'au début du XXe siècle,
avec la découverte des gaz rares dont l'air contient des
quantités infimes.
retour haut de page
La pression d'un
mélange gazeux (comme l'air) est définie par la somme
des pressions partielles que chaque gaz exercerait s'il
était seul. Ainsi dans un air sec, à
pression atmosphérique normale (760 mm de mercure ou 1
atmosphère ou 101,3 kPa), la pression partielle du
dioxygène est de 159,2 mm d'Hg, celle de l'azote 600,6 mm d'Hg
et celle du dioxyde de carbone 0,2 mm d'Hg. Dans un air
humide (comme l'est l'air naturel et surtout l'air au niveau
des poumons, chaud et saturé de vapeur d'eau), la vapeur d'eau
exerce une pression partielle qui s'ajoute aux autres et donc diminue
leur valeur. En altitude, si l'on diminue la pression, on diminue
aussi les pressions partielles. À 6000 m d'altitude par
exemple (pour une pression atmosphérique de 380 mm d'Hg), la
pression partielle de dioxygène n'y est plus que de 80 mm
d'Hg. C'est pour cela que l'on peut survivre à plus haute
altitude en respirant du dioxygène pur. (Schmidt-Nielson, p 6
et s.)
La pression atmosphérique correspond à une
valeur très élevée: 100 kPa correspond à
une pression d'environ 1 kilogrammeforce par centimètres
carrés soit 10 tonnesforce par mètre carré.
(Unité de pression qui n'est plus utilisée mais qui
peut être compréhensive: la pression exercée par
une colonne de 10,033 m d'eau de section 1 centimètre
carré est égale à 1033 gramme force soit 1
kilogramme force). Quand on gonfle un pneu à "1 kg" cela
signifie en fait que la pression de l'air à l'intérieur
du pneu est supérieure de 1kgforce à la pression
atmosphérique soit environ 2 atmosphères). La pression
de distribution de l'eau courante atteint facilement 4
atmosphères et est obtenue grâce à la position
très élevée des châteaux d'eau par rapport
aux points de distribution; ce n'est pas le château d'eau qui
contient de l'eau à cette pression (normalement les
réservoirs sont en communication avec l'air libre et l'eau y
est donc soumise à la pression atmosphérique).
Voici un petit historique pour comprendre comment
petit-à-petit cette conception de la pression
atmosphérique est arrivée à s'imposer.
« Aristote ne parvint pas à peser l'air et les
échecs se succédèrent jusqu'au
XVIIe siècle. Galilée, interrogé sur
l'impossibilité de pomper l'eau des puits à une hauteur
de plus de 10 mètres, doit admettre que «la nature a une
horreur modérée du vide», selon la théorie
de l'époque. Evangelista Torricelli
remplace l'eau par du mercure: la colonne n'est plus alors que de 76
centimètres, ce qui représente le même poids que
10 mètres d'eau. Il lui faut donc admettre que ce poids est
équilibré par la pression de l'air, ou pression
atmosphérique. Pascal pense que, si cette
explication est la bonne, la colonne de liquide doit être moins
haute en altitude puisque l'épaisseur de la couche d'air y est
moins grande, ce que son beau-frère Florin
Périer vérifie le 19 septembre
1648, entre Clermont-Ferrand et le sommet du puy de
Dôme.»
Pour plus de détails sur l'atmosphère,
l'ozone, l'effet de serre, voir la page
complémentaire.
retour haut de page
hygrométrie:
teneur de l'air en eau. Elle est chiffrée habituellement par
l'humidité relative qui n'atteint cependant
jamais 0 (absence absolue d'eau) dans la nature; la valeur 100
correspond à la saturation. Mais la quantité d'eau
réellement présente dans l'air dépend bien
sûr grandement de la température et de la pression. Plus
on s'élève en altitude, plus la pression baisse et
moins l'air contient d'eau, à température égale.
On remarquera que les nuages, en altitude sont d'excellents
indicateurs de la saturation. De la même façon, plus on
s'abaisse en température, moins l'air contient d'eau, à
température égale. En hiver l'humidité relative
reste forte mais l'air est très sec. Une humidité
relative de 70% à 80% est fréquente en France EN
ÉTÉ. D'une façon très
générale seuls les déserts on dont un air sec
dont l'humidité relative ne dépasse pas 50%. Les 100%
sont quasi permanents dans les pays tropicaux.
La mesure de l'hygromètrie est difficile, du fait de la
variation simultanée de la pression et de la
température. Les appareils les plus sûrs utilisent des
méthodes spectrocopiques. Les appareils utilisant des cheveux
où une baudruche sont assez fiables dans certains domaines de
température et de pression.
Les météorologistes utilisent d'autres
valeurs de l'humidité, notamment le rapport de
mélange , c'est-à-dire, en grammes par
kilogramme, le rapport de la masse d'eau à la masse d'air sec
qui la contient, et l'humidité spécifique ,
qui exprime la quantité d'eau en grammes par kilogramme de
l'air humide qui la contient. On utilise aussi parfois la notion de
concentration en vapeur d'eau, ou humidité absolue, en
exprimant le nombre de grammes d'eau sous forme de vapeur par
mètre cube d'air du mélange
considéré.
Le temps de résidence moyen d'une molécule d'eau
dans l'atmosphère (temps moyen pendant lequel une
molécule d'eau reste dans l'atmosphère) est
considéré comme extrêmement court : il est de
l'ordre de quelques semaines, quelquefois de quelques heures dans de
l'air instable où des averses se forment de manière
continue. Il peut atteindre sans doute plusieurs mois ou même
des années si les molécules évaporées
à la surface du globe ont été
transportées dans la circulation stratosphérique ou ont
pu franchir le niveau de la stratopause.
|
température (°C)
|
vapeur d'eau au dessus d'une surface d'eau
libre à différentes
températures
|
|
0
|
4,6 mm d'Hg
|
0,61 kPa
|
0,6 % de 1 atm
|
4,8 mg d'eau par litre d'air
|
|
37
|
46,9
|
6,28
|
6,2
|
43,9
|
|
100
|
760
|
101,33
|
100,0
|
598,0
|
L'eau bout à 100°C à la pression
atmosphérique (760 mm d'Hg). Si l'on abaisse la pression
à 46,9 mm d'Hg (19.000 m d'altitude!) l'eau bout
à 37°C (la température du corps humain).
On notera aussi combien l'air froid (en équilibre avec
une surface d'eau libre) est sec (0,6% d'eau à 0°C
sous 1 atm).
retour haut de page
conductibilité
thermique: quelques valeurs (en
cal.m-3.h-1.°C-1 ou 1,1628
W.m-1.K-1) pour comparer (in Encyclopedia
Universalis):
|
matière ou matériau
|
conductibilité thermique
|
|
air
|
0,02
|
|
panneaux isolants en fibre de bois
|
0,03
|
|
brique creuse
|
0,50
|
|
brique pleine
|
0,70
|
|
béton
|
1,20
|
|
ardoise
|
2,50
|
Ces valeurs, utilisées par les techniciens du
bâtiment ne sont pas d'une grande utilité pour les
biologistes. L'air en couche épaisse et pouvant circuler
librement est un très mauvais isolant thermique. Il devient
bien plus efficace, proportionnellement, en couche mince et
emprisonné dans de petits volumes où les courants de
convection ne peuvent pas s'établir. C'est bien
évidemment ce qui est recherché dans les produits
industriels isolants: mousses et panneaux de fibres...mais c'est
aussi ce qui est réalisé dans la nature avec les
fourrures ou les plumages.
|
quelques
comportements et dispositifs pour lutter contre le
froid et/ou le
chaud chez les
animaux
|
|
Les fourrures ébouriffées sont
interprétées comme des adaptations des
mammifères aux variations de températures
(pensez à la froidure des nuits dans les
déserts, aux climats polaires, aux saisons dans les
pays tempérés). L'arrection des poils
(grâce à un muscle arrecteur situé
à sa base) permet à la fourrure d'augmenter
fortement de volume et de mettre en place ainsi un matelas
d'air isolant.
On notera aussi que l'épaisseur des
fourrures change selon les saisons. Les mammifères
aquatiques ont surtout une couche de graisse isolante sous
leur pelage.
Pour les oiseaux l'ébourriffage des
plumes est aussi pratiqué, tout comme l'action de
rentrer tête et pattes dans leurs plumes.
|
L'observation de fourrures, de coupes de peau permet de
préciser les dimensions biologiques.
Pour faire vraiment des expériences on peut,
même avec les tout petits, travailler sur ce qui
permet à la glace de ne pas fondre (une couverture en
laine, une fourrure, un sac en plastique, une boîte en
bois, une boîte en métal....). Pour les plus
grands on peut même travailler en technologie sur la
fabrication d'un sac isolant plus performant que ceux du
commerce....
|
|
Pensez à une bernique. A marée haute, elle
ne craint pas le gel. Mais à marée basse elle
peut être exposée à des
température de -30°C dans certains pays pendant
plusieurs heures. Et supporter aussi des alternances rapides
de gel/dégel. Les études (Schmidt-Nielson, p
229) ont prouvé que les berniques et de nombreux
invertébrés de la zone de balancement des
marées gèlent à plus de 90%. Les
cristaux de glace provoquant une déformation
importante des muscles et des organes internes. Mais ils se
situeraient à l'extérieur des cellules qui se
trouvent rétrécies et ne contiennent sans
doute pas de glace. On peut notamment congeler et
décongeler autant que l'on veut les larves de
chironomes (Chironomus, un petit insecte dont la
larve, rouge est utilisé comme appât pour la
pêche) sans créer de lésion... à
vos congélateurs.
Il est important de noter que pour de
nombreux animaux les tolérances à des
températures extrêmes ne s'observent que
pendant certaines périodes de l'année... je ne
sais pas s'il n'y a pas aussi des
sous-espèces.
|
Il est fortement déconseillé de faire en
classe des expériences visant à
démontrer la tolérance de tel ou tel organisme
à des conditions extrêmes.
|
retour haut de page
Comparaison entre
l'eau et l'air (in Schmidt-Nielsen, p
14)
|
paramètre
|
eau
|
air
|
commentaire
|
|
concentration en dioxygène
(à 15°C, en
masse, pour
une eau en équilibre avec
l'atmosphère)
|
0,007%
|
0,209%
|
Pour 1 litre (1000 mL) d'air on a 209 mL de
dioxygène soit 0,27 g (1L d'air pèse 1,293 g
car la masse volumique de l'air est de 1,293 kg.m-3 ou
g.L-1). Pour 1L d'eau (1000 mL) on a 7 mL de
dioxygène soit 10 mg soit 100.000 fois moins que la
masse d'eau (1.000.000 mg). Il y a donc bien une
différence de masse inerte formidable entre les
deux milieux. Pour obtenir 1 g de dioxygène il faut
déplacer une masse 1.000.000 de fois plus grande pour
l'eau alors que le rapport est un peu plus de 3 pour
l'air.
|
|
coefficient de
diffusion du dioxygène (cm2.s-1)
|
0,000025
|
0,198
|
l'oxygène diffusant beaucoup plus vite dans l'air
que dans l'eau, le renouvellement du milieu peut être
beaucoup plus lent dans l'air que dans l'eau. Les grands
poissons ont besoin d'une nage active permanente pour
extraire efficacement le peu de dioxygène de l'eau.
Les filaments branchiaux ne peuvent être efficaces que
s'ils sont agités en permanence ou si le milieu est
renouvelé (milieu battu par exemple).
|
|
densité (kg.L-1)
|
1,000
|
0,0013
|
|
|
viscosité (à 20°C en centipoise =
cP)
|
1
|
0,02
|
|
|
chaleur spécifique (cal.L-1.°C-1)
|
1.000
|
0,31
|
|
|
conductivité thermique (cal.s-1.°C-1)
|
0,0014
|
0,000057
|
|
Les différences physiques entre l'eau et l'air, dont les
animaux sont tributaires, sont d'abord relatives aux
propriétés respiratoires de ces deux milieux: à
18 °C, la capacitance* de l'oxygène est 29 fois plus
grande dans l'air que dans l'eau, alors que celle du dioxyde de
carbone est identique dans ces deux milieux. Elles touchent en second
lieu aux propriétés mécaniques, essentiellement
la viscosité et la densité, respectivement 60 fois et
800 fois plus grandes à 15 0C dans l'eau que dans
l'air. Quant aux propriétés qui assurent la dissipation
de la chaleur, elles apparaissent clairement à travers deux
chiffres: la capacité calorique de l'eau est 3 400 fois
plus grande que celle de l'air, et sa conductivité calorique
l'est 24 fois plus. De telles différences ne peuvent pas ne
pas modifier le fonctionnement des organismes vivants. (in
Encyclopedia Universalis, article"ANIMAL (RÈGNE) - Vie animale
dans l'eau et dans l'air" de Pierre DEJOURS).
*Certains auteurs remplacent la solubilités des gaz dans l'air
par le terme de capacitance définit comme le rapport entre la
variation de la concentration de l'oxygène (ou du dioxyde de
carbone, de l'azote, etc.) et la variation de sa pression partielle:
elle mesure la capacité d'un milieu à contenir un gaz,
en fonction de la pression partielle de ce gaz.
|
en mm d'Hg
|
O2
|
CO2
|
|
en kPa
|
entrant
|
sortant
|
entrant
|
sortant
|
|
poisson
(eau douce)
|
150
20
|
100
13
|
0,3
0,04
|
2,0
2,7
|
|
homme
(mammifère aérien)
|
150
20
|
120
16
|
0,3
0,04
|
25
3,6
|
A pression partielle égale le travail nécessaire pour
extraire la même quantité de dioxygène n'est pas
du tout équivalent dans l'air et dans l'eau (cf ci-dessus).
Les animaux aériens ont un travail respiratoire de prise de
dioxygène beaucoup plus faible que les animaux aquatiques (10
à 20% de la dépense énergétique totale).
Par contre le dioxyde de carbone est plus soluble dans l'eau que dans
l'air et l'excrétion du dioxyde de carbone est plus facile
pour les animaux aquatiques que aériens. Les animaux
aériens possèdent un sang riche en ions bicarbonate
(acidose) caractéristique. De même les animaux
aériens perdent de l'eau lors de leur respiration ce qui
occasionne une dépense énergétique non
négligeable (quelques % -au maximum- de leur dépense
énergétique totale cependant).
Chez beaucoup d'animaux aquatiques, la surface d'échanges
externe est augmentée par le développement
d'évaginations de la surface du corps, simples plissements des
téguments ou bien branchies, qui peuvent être soit
libres dans le milieu extérieur (par exemple, chez les larves
de Batraciens), soit cachées dans une cavité
palléale chez les Mollusques, dans une cavité
branchiale chez les gros Crustacés et chez les Poissons.
Par contre, chez les Mollusques pulmonés, chez quelques
Poissons, les Dipneustes, chez la plupart des Amphibiens et tous les
autres Vertébrés, l'invagination de l'endoderme conduit
à la formation de poumons, généralement
aériens. Chez les Mammifères, les poumons sont
subdivisés en alvéoles, particulièrement
nombreux. Chez les Oiseaux, ils sont formés de tubes
parallèles, les parabronches, d'où émergent
radialement de petits canaux, les capillaires aériens, qui
viennent au contact des capillaires sanguins.
La formation de poumons apparaît comme la seule
possibilité offerte aux animaux, à l'exception des
Insectes, pour pouvoir évoluer librement dans
l'atmosphère, car la vie aérienne n'est possible que si
deux conditions sont remplies: faible perte d'eau, échanges
respiratoires suffisants. La peau des Reptiles, des Oiseaux et des
Mammifères étant presque imperméable à
l'eau, la seule perte d'eau importante s'effectue par la respiration
pulmonaire; mais, grâce à la grande richesse de l'air en
oxygène, la convection ventilatoire d'air et, par suite, la
perte d'eau avec le gaz expiré, saturé de vapeur d'eau,
sont faibles. La situation est toute différente chez les
Amphibiens, dont la respiration cutanée est obligatoire: ou
bien ils vivent plus ou moins immergés dans l'eau ou bien,
s'ils sont aériens, leur peau devant être humide pour
rester perméable aux gaz, ces animaux demeurent au voisinage
des points d'eau ou tout au moins séjournent dans une
atmosphère très humide.
Disposer d'une large surface d'échanges gazeux est une
condition nécessaire aux animaux de grande taille; il est
indispensable de surcroît que le milieu ambiant, au contact de
cette surface, soit renouvelé. Chez certains
Invertébrés, la convection de l'eau est assurée
par les mouvements de l'animal ou par le battement de cils. Mais pour
les animaux plus complexes, une convection massive du milieu externe
est nécessaire. Chez les animaux aériens, la convection
est bidirectionnelle , consistant en des mouvements de
va-et-vient d'air, milieu léger, peu visqueux, dont la
richesse en oxygène autorise un débit
modéré. En revanche, l'eau, pour une tension
d'oxygène donnée, contient beaucoup moins
d'oxygène que l'air, si bien que le débit de convection
chez les animaux aquatiques est relativement considérable. Par
exemple, un Vertébré aérien ventile
20 à 30 litres d'air pour en retirer 1 litre
d'oxygène, alors qu'un Poisson fait circuler 300 à
500 litres d'eau pour en extraire la même quantité.
Mais une circulation si considérable pose des problèmes
mécaniques particuliers aux animaux aquatiques, puisque l'eau
est 800 fois plus dense et 60 fois plus visqueuse que
l'air: une convection bidirectionnelle par va-et-vient d'eau, comme
celle de l'air chez les Vertébrés supérieurs,
nécessiterait un travail considérable. En fait, la
seule solution possible réside dans un mécanisme de
convection unidirectionnelle de l'eau qui, entrant par la
bouche et s'échappant par les fentes operculaires,
s'écoule d'une manière presque continue à
travers les lamelles branchiales.
retour haut de page
solubilité des
gaz dans l'eau : "de l'air dans l'eau"
La quantité de molécules de gaz dissous dans
l'eau dépend de la nature de chaque gaz, de la pression du gaz
dans la phase gazeuse, de la température et de la
présence d'autres substances dissoutes.
On doit aussi savoir que le dioxyde de carbone est beaucoup plus
soluble que le dioxygène dans l'eau, à
température et pression égale (à 15°C sous
1 atm, on dissous 31,1 mL de dioxygène et 1019,0 mL de dioxyde
de carbone dans 1L d'eau). Dans une bouteille d'eau gazeuse non
encore ouverte, il règne une pression de 2 à 3 atm (2
à 3.105 Pa). C'est la grande solubilité du gaz
carbonique qui est responsable des bulles. Si l'on chauffe le liquide
(un bière tiède !) le gaz s'échappe fortement
car la solubilité diminue avec l'augmentation de
température (à l'inverse des solides qui sont souvent
plus solubles dans les liquides quand on élève la
température : faites fondre du sel dans de l'eau froide et
chaude et comparez).
La pression du gaz dans l'eau est souvent appelée
tension. Comme pour les pressions partielles dans un
mélange de gaz, la pression partielle du mélange gazeux
en solution dans l'eau est la somme de toutes les tensions. Quand la
pression extérieure diminue, les gaz dissous dans l'eau ont
tendance à quitter la solution (débouchez votre
bière). Si l'on fait le vide, on extrait la totalité
des gaz du liquide.
Dans les eaux naturelles le dioxygène de carbone ne reste pas
en solution mais entre en équilibre avec les ions carbonates
et bicarbonates présents eux-même en solution. Un eau
"dure" (on dit aussi calcaire) contient par exemple de grande
quantité d'hydrogénocarbonate de calcium (Ca2+
HCO32-). Ces ions réalisent un
effet tampon qui atténue les variations de concentration en
dioxyde de carbone dissous qui se trouve donc habituellement proche
de la valeur obtenue à l'équilibre avec
l'atmosphère. Ce n'est que dans des conditions
particulières de pression (grottes: stalactites et
stalagmites) ou de température (évaporites) que les
carbonates précipitent et donnent des dépôts
calcaires. Cependant il faut noter que la quasi-totalité des
dépôts de calcaires connus (y compris les calcaires de
précipitation et d'évaporation cités plus haut)
mettent en jeu des processus biologiques avec notamment des
bactéries. On pensera aussi aux innombrables coquilles
calcaires des invertébrés.
transport de
particules par le vent
Le diagramme de Hiulström présente les conditions
expérimentales de transport des particules par un fluide en
mouvement:
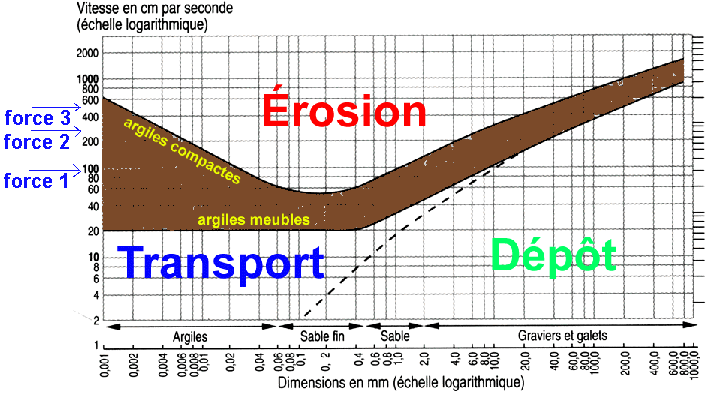
Diagramme de Hjulström
présentant les conditions (empiriques) de transport
de particules par un fluide en mouvement (eau ou air).
(la zone brune correspond au domaine où les
forces électrostatiques entre particules sont
importantes).
Sur le côté gauche sont portées des indications
approximatives de vitesse de vent (voir échelle de
Beaufort ci-dessous). On considère habituellement qu'une
particule éolisable (susceptible d'être
transportée par le vent) est comprise entre 0,03 et quelques
millimètres de diamètre. Les particules
inférieures à 0,1 mm étant transportées
en suspension, les particules comprises entre 0,1 et 1 mm
étant transportées par saltation, les particules
de diamètre supérieur étant
roulées ou déplacées par
reptation.
|
Echelle
de Beaufort
(hauteur standard de 10 m au-dessus d'un terrain plat
découvert)
|
vitesse
|
pression
(kg/m2)
|
|
degré de l'échelle
|
effets produits par le vent
|
m/s
|
km/h
|
|
0
|
calme
|
calme, la fumée s'élève
verticalement
|
0 à 0,2
|
<1
|
0 à 0,15
|
|
1
|
très légère brise
|
la direction du vent est révélée par
le sens de la fumée mais non par la girouette
|
0,3 à 1,5
|
1 à 5
|
0,16 à 0,50
|
|
2
|
légère brise
|
on perçoit le souffle du vent sur le visage, une
girouette ordinaire est mise en mouvement
|
1,6 à 3,3
|
6 à 11
|
0,51 à 2
|
|
3
|
petite brise
|
les feuilles et les petites branches sont constamment
agitées, le vent déploie les pavillons
légers
|
3,4 à 5,4
|
12 à 19
|
3 à 5
|
|
4
|
jolie brise
|
le vent soulève la poussière et les
papiers, fait mouvoir les petites branches
|
5,5 à 7,9
|
20 à 28
|
6 à 8
|
|
5
|
bonne brise
|
les arbustes en feuilles se balançent, des
vaguelettes crêtées se forment sur les lacs ou
les étangs
|
8 à 10,7
|
29 à 38
|
9 à 12
|
|
6
|
vent frais
|
les grandes branches bougent, les fils
télégraphique bougent, l'usage des parapluies
devient difficile
|
10,8 à 13,8
|
39 à 49
|
13 à 20
|
|
7
|
grand frais
|
les arbres entiers sont agités, il est
pénible de marcher contre le vent
|
13,9 à 17,1
|
50 à 61
|
21 à 30
|
|
8
|
coup de vent
|
les petites branches des arbres sont brisées
|
17,2 à 20,7
|
62 à 74
|
31 à 45
|
|
9
|
fort coup de vent
|
le vent peut endommager les constructions
légères (cheminées et ardoises
arrachées)
|
20,8 à 24,4
|
75 à 88
|
46 à 60
|
|
10
|
tempête
|
cas rarement observé à l'intérieur
des terres, graves dégâts aux constructions
|
24,5 à 28,4
|
89 à 102
|
61 à 85
|
|
11
|
violente tempête
|
très rarement observé, ravages
étendus
|
28,5 à 32,6
|
103 à 117
|
86 à 120
|
|
12
|
ouragan
|
principalement observé dans les régions
à cyclone, exceptionnellement sous nos latitudes
|
32,7 et plus
|
118 et plus
|
121 et plus
|
retour haut de page
|
L'air
sensible
|
|
voir
|
De nombreux organismes (animaux, bactéries) sont
sensibles aux infra-rouges (fossettes
réceptrices des serpents...) et aux
ultra-violets (œil à facettes des
insectes...).
Le bleu du ciel et le rougissement du soleil à
l'horizon sont dues aux absorptions et aux diffusions des
rayons lumineux solaires par les gaz de l'air.
une grande cuve parallélépipédique
d'eau contenant quelques gouttes de lait (jouant le
rôle de molécules diffusantes) est
éclairée par un fort spot de lumière
blanche. Dans la direction du plus grand axe la
lumière est rouge-orangée (couleur moins
diffusée) alors qu'elle est bleutée sur les
côtés de l'aquarium (bleu très
diffusé). Cette maquette
proposée par André Giordan et Françoise
et Jack Guichard dans "Des idées pour apprendre"
(Z'Editions, p 246) a le gros défaut de remplacer
l'air par de l'eau.
Dans l'air la lumière, peu
atténuée est captée par les plantes qui
utilisent l'énergie solaire.
L'air est aussi le milieu le plus propice à la
vision, nocturne ou diurne. L'oeil humain n'est
sensible qu'aux radiations du domaine du visible (voir cours
je vois). Les illusions
d'optiques sont dues à traitement erroné de
l'information par le cerveau.
|
|
entendre
|
La vitesse de propagation, ou
célérité, d'un son dans un milieu
élastique possède une propriété
remarquable: elle ne dépend que du milieu
considéré et de son état de
température et de pression; elle ne dépend pas
du son qui se propage, de sa nature, de sa fréquence
ou de son intensité (sauf dans le cas
d'ébranlements très violents, comme les
explosions). Dans l'air à la température
ordinaire, la célérité du son est de
l'ordre de 340 m/s. C'est parce que le vent est cause
d'une célérité inhomogène qu'il
« porte » le son. Cependant, les ondes
sonores peuvent aussi « contourner » les
obstacles, ce qui correspond au phénomène
ondulatoire de diffraction. Si la longueur d'onde de la
vibration est grande par rapport à l'obstacle, cet
obstacle perturbe à peine la propagation. La longueur
d'onde des sons audibles varie entre 17 mètres
(pour un son de 20 Hz) et 17 millimètres
(pour un son de 20 000 Hz): un obstacle de
dimensions intermédiaires peut donc porter
« ombre acoustique » sur les sons de
fréquence élevée, il peut être
« contourné » par les sons de
fréquence grave. Les composantes de fréquence
élevée d'un son complexe sont le plus
facilement arrêtées par des obstacles. (in
Enceclopedia Universalis, article "acoustique")
la vitesse des sons est faible dans
l'air
Les animaux communiquent souvent dans l'air
par des sons et des ultra-sons.
L'oreille est un organe des sens
particulièrement sophistiqué qui permet
d'entendre des sons (voir cours: j'entends)
mais aussi de les comprendre, grâce au cerveau. Les
sons sont émis par les cordes vocales chez
l'homme (voir cours je parle ).
L'écho-location, pratiquée par certains
oiseaux (martinets d'Asie...) mammifères
aériens (chauve-souris) et aquatiques
(cétacés, dauphins...) utilise les ultra-sons.
Par exemple les chiroptères à activité
nocturne et parfois crépusculaire qui se nourrissent
d'insectes, les repèrent en vol et dans
l'obscurité, par un système
d'écholocation très perfectionné qui
leur permet aussi d'éviter les obstacles. Les
ultra-sons peuvent être émis à une
cadence de 200 par seconde, avec une fréquence de 50
à 120 kilocycles par seconde, d'une durée
très courte, souvent de l'ordre de la milliseconde.
Il est à noter que ce système comprend donc
à la fois un émetteur d'ultra-sons (cordes
vocales) et un récepteur (oreilles aux pavillons fort
développées).
|
|
sentir
|
l'air est plein de molécules
odorantes naturelles
|
|
les odeurs, parfums exhalés par les
plantes et les animaux en milieu aérien sont autant
de signaux de communication. Le nez est
l'organe de l'odorat humain (voir cours).
Certains animaux ont un odorat si développé
qu'ils reconnaissent une molécule émise par un
animal très éloigné (voir des
expériences historiques de Favre par exemple sur les
insectes : femelle du grand Paon de nuit...)
Toutes les expériences visant à faire prendre
conscience aux enfants des capacités de leur odorat
sont intéressantes. les lotos des odeurs,
particulièrement (quelques
pistes
vues avec les PE2 sur les boîtes tactiles,
transposables aisément)
|
retour haut de page
|
l'air
porteur ou moteur
|
|
voler : l'air
porteur
On peut sans hésiter affirmer que c'est bien les
animaux volants mais aussi les différentes formes
planantes végétales qui ont inspiré
l'homme à essayer de réaliser des machines
volantes (aéronautique: naviguer dans l'air).
L'aérodynamique (la sciences des mouvements dans
l'air) est une science extrêmement complexe et nos
incursions ne pourront tout au plus que donner l'envie aux
élèves d'approfondir.
|
|
activement:
voler avec des ailes
|
Le vol nécessite de grandes surface
portantes. Les exemples les plus classiques pour ce qui
est des mécanismes passifs ce sont les
expansions et autres ballonnets (pollen de pin,
graines-fruit de l'érable, akènes de
pissenlit...) favorisant une dispersion par le vent
(anémophile). Pour ce qui est des mécanismes
actifs les trois modèles principaux étant
l'aile d'insecte (papillon, libellule, mouche....),
les expansions de la peau (grenouilles, reptiles
volants et chiroptères: chauves-souris), et enfin
l'aile des oiseaux avec les plumes.
|
|
passivement :
se laisser porter, se laisser emporter,
planer...
|
in Encyclopédie Universalis,
article "vol animal"
|
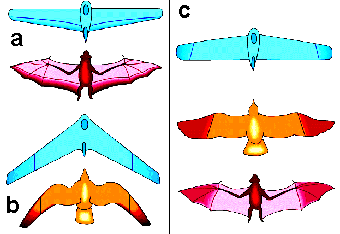
La stabilité en tangage n'est pas assurée
par un empennage indépendant chez les Oiseaux,
Ptérosaures et Chiroptères
évolués, mais par des artifices
employés aussi sur les ailes volantes (d'après
Pennycuick).
En a : cambrure réfléchie,
région grisée (bord de fuite) avec
déflexion vers le haut (ailes volantes Fauvel et
chauves-souris planantes).
En b : voilure en flèche avec
déflexion, les régions marginales
grisées ont une incidence négative (ailes
volantes Horten et oiseaux en plané rapide).
En c : extrémités d'ailes à
dièdre négatif, régions marginales
(grisées) à déflexion vers le bas
(ailes volantes Northrop, oiseaux et chauves-souris).
Voir un travail sur l'apparition
du vol chez les oiseaux et les ptérosaures dans
le cadre de l'évolution.
|
|
Quelques exemples du livre "Avions de papier",
Idées Usborne, 1992
modèles à décalquer p 30
|
* le carré volant: comment plier une
feuille de papier en carré et modifier ensuite ses
caractéristiques pour améliorer son vol: p 4
et 5: notions de surface portante, bord d'attaque et
stabilisateurs; vol plané, décrochage et
piqué.
* l'écureuil volant: p 8-9; une fois
les principes du vol plané acquis cet exemple
constitue une bonne application
|
* le petit voltigeur: p 14-15; un avion
capable de voler rapidement et de faire des figures (en S
avec virages latéraux sur l'aile, en boucle....)
* la mouette: p 16-17: un modèle
assez complexe qui met en application les principes vus dans
le petit voltigeur...
|
|
L'adaptation au vol touche l'ensemble de
l'organisme, tant au point de vue anatomique (disposition
des organes) que physiologique (fonctionnement, notamment
énergétique).
|
|
flotter
et se déplacer avec des gaz = l'air
moteur
|
|
l'argon et les autres gaz inertes de l'air
ne sont quasiment pas utilisés par les organismes
vivants
|
La vessie natatoire (ou vessie gazeuse) des
poissons Téléostéens (aussi bien marins
comme la morue, que d'eaux douces comme l'anguille) stocke
des gaz dont parfois de grandes quantité d'azote et
de gaz rares. Elle assure la flottabilité
passive.
|
retour haut de page
|
L'air
nourricier
|
|
comment
les êtres vivants respirent-ils ?
|
|
Comment les échanges de gaz (respiratoires
mais aussi nourriciers nécessaires à la
photosynthèse) se font-ils dans les
différents groupes d'organismes ?
Avant de pénétrer dans l'organisme vivant qui
est fondamentalement aqueux (environ 60 à 80%
d'eau), les gaz sont toujours dissous dans l'eau. De
là ils peuvent diffuser dans l'organisme. Certains,
pour faciliter les échanges ont des surfaces
externes (branchies) ou internes (poumons,
trachées...) très développées. A
l'intérieur des "grands" organismes les gaz sont
transportés par des pigments respiratoires
(principalement l'hémoglobine) au sein de
l'appareil respiratoire.
La respiration de nombreux organismes en milieu
aérien peut se faire par un seul orifice assurant
à la fois l'entrée (inspiration) et la sortie
(expiration) de l'air. La masse inerte d'azote à
déplacer et bien plus faible que la masse d'eau (voir
comparaison eau/air).
Cependant le renouvellement de l'air met en jeu de nombreux
mécanismes "astucieux" (sacs aériens et
poumons tubulaires des oiseaux, trachées des
insectes...).
Tous les types biologiques respiratoires possibles ne sont
pas représentés ci-dessous.
|
|
par taille et type d'organismes
|
par milieu
|
|
dans l'eau
|
dans l'air
|
|
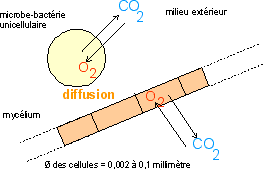
un "tout petit"
organisme:
- une cellule (bactérie-microbe ou unicellulaire)
- un champignon (un filament composé d'une file de
cellules: le mycélium)
|
|

les "tout petits" organismes ne survivent pas dans l'air
sauf sous une forme de résistance comme les
spores (elles ont une vie ralentie: leur respiration
n'est pas mesurable).
|
|
les "grands" organismes
(composés de nombreuses cellules)
|
plantes
|
les algues vertes sont classées dans les
unicellulaires ainsi que la plupart des algues rouges
les algues brunes sont souvent émergées
(zone de balancement de marées) mais respirent par
diffusion des gaz comme les petits organismes qui vivent
dans l'eau
les mousses vivent en milieu humide et les
échanges de gaz se font par diffusion.
|
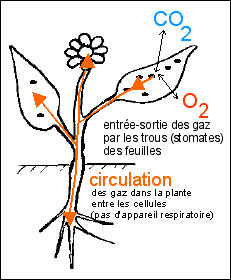
ex: fougères, plantes à fleurs
|
|
animaux
(les schémas correspondent
à des coupes transversales)
|
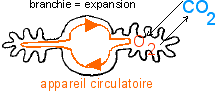
Les branchies sont des
surfaces d'échange de gaz spécialisées
entre le milieu extérieur (l'eau) et le milieu
intérieur (sang, circulant dans l'appareil
circulatoire). C'est l'appareil circulatoire qui distribue
les gaz aux cellules.
ex: moule (invertébré), poisson
(vertébré: les branchies sont dans une
cavité et sont protégées par un
opercule)
Remarque: certains insectes aquatiques respirent
avec des trachées mais font des provisions d'air en
surface avant de plonger.
|
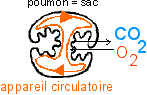
Les poumons sont des
surfaces d'échange de gaz spécialisées
en forme de sac. C'est encore l'appareil circulatoire qui
distribue le gaz aux cellules.
ex: escargot, grenouilles, serpents, oiseaux,
mammifères
Remarque: certains animaux en milieu humide mais
aérien ne respirent que par la peau sans avoir de
surface réellement spécialisée (ex:
lombric...)
|
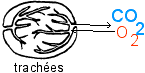
Les trachées
des insectes sont des tubes extrêmement fins qui
amènent directement les gaz aux cellules (ils
sont d'ailleurs pleins d'eau à leur
extrêmité, là où se font les
échanges de gaz entre l'air et le milieu
intérieur). L'appareil circulatoire a alors un
rôle moindre dans le transport des gaz
respiratoires.
|
|
l'hémoglobine
et le transport des gaz par le
sang
|
|
Ce n'est pas la quantité de dioxygène
présent dans l'air qui reflète sa
disponibilité. C'est essentiellement sa pression
partielle qui dépend de la
température, de la pression (et donc de l'altitude)
et aussi de la composition en autres gaz. Pour des
organismes unicellulaires l'oxygène qui diffuse plus
ou moins vite (voir comparaison
eau/air) est distribué dans toutes les parties de
la cellule facilement. Pour les pluricellulaires, des
appareils circulatoires prennent en charge les gaz
respiratoires.
|
|
les échanges gazeux au niveau des surfaces
d'échange (poumon, trachées) se font en
présence d'eau (film d'eau).
|
|
Chez tous les vertébrés le pigment
respiratoire rouge : l'hémoglobine
(protéine à fer) est contenue dans des
cellules : les globules rouges. Une molécule
d'hémoglobine (4 chaînes protéiniques de
globine et 4 atomes de fer) prend en charge 4
molécules de dioxygène à l'aller (des
poumons aux tissus) et une molécule de dioxyde de
carbone au retour (des tissus aux poumons). D'autres
pigments respiratoires existent chez les
invertébrés. On trouve de l'hémoglobine
particulière chez certains végétaux :
elle fixe le dioxygène pour permettre la
réalisation de réactions chimiques sans cette
molécule qui dans une cellule est un poison
violent.
|
|
se nourrir
avec des gaz
|
|
Du point de vue chimique, le dioxygène, dans la
respiration, sert d'accepteur d'électrons à la
fin de la chaîne respiratoire (le dioxygène,
plus des électrons plus des protons (H+) donne de
l'eau dite métabolique). C'est le
célèbre bilan valable aussi bien pour la
respiration que pour la photosynthèse:
C6H12O6 + 6 O2
<=> 6CO2 + 6H2O + chaleur
(voir cours sur la nutrition)
|
|
La pression partielle de dioxyde de carbone est
très faible dans l'atmosphère (0,03% soit
0,031 kPa ou 0,23 mm d'Hg). En même temps que la
plante fait entrer son dioxyde de carbone elle perd beaucoup
d'eau (évapo-transpiration). Certaines plantes
ferment leur stomates (orifice d'entrée et de
sortie des gaz de la feuille) le jour, lorsque
l'humidité est faible, et ne les ouvrent que la nuit,
lorsque l'humidité est maximale (et donc que les
pertes en eau sont moindre). Elles doivent alors stocker le
dioxyde de carbone qui servira aux réactions de
synthèse le jour.
|
|
Le diazote est utilisé par certaines
bactéries comme source de matière
azotée : ces bactéries comme notamment les
cyanophycées ou bactéries bleues sont parfois
associées (association à
bénéfices réciproques = symbiose) avec
des plantes supérieures (Légumineuses (engrais
vert), fougères) ou des champignons (certains
lichens).
|
|
boire en milieu
aérien
|
|
Dans l'air humide (mais aussi chaud, ce qui fait que
c'est surtout dans les pays tropicaux que l'on observe le
phénomène : voir hygrométrie)
certaines plantes captent l'eau par leur racines, leurs
tiges ou leurs feuilles (certaines plantes épiphytes
: qui vivent sur d'autres organismes végétaux
- du grec "épi"="au-dessus"). Par exemple les
fougères du genre Platyceras (cornes de cerf),
des Orchidées ou autres Broméliacées
que l'on trouve chez les fleuristes. Pour voyager on peut
aller visiter la partie supérieure du pavillon
tropical d'Océanopolis.
|
|
l'air
hostile - la vie sans air
|
|
Un organisme capable de se développer en
présence du dioxygène atmosphérique est
un aérobie (aérobie est un adjectif
dont le substantif est aérobiose: c'est un
organisme qui vit en aréobiose). Les
organismes capable de croître en absence de
dioxygène sont dits anérobies (capables
de vivre en anarobiose).
Parmi les aérobies, certains organismes
dépendent du dioxygène pour vivre, ils sont
donc aérobies obligatoires (ils utilisent le
dioxygène dans leur respiration, comme les plantes et
les animaux). D'autres ne nécessitent pas ce
dioxygène, ils utilisent un autre
élément (une substance organique ou
minérale dans leur respiration). Ils sont dits
aérobies aérotolérants s'ils
acceptent quand même la présence de
dioxygène dans le milieu et anaérobies
stricts ou obligatoires dans le cas contraire (ils
meurent alors ou cessent de se développer en
présence de dioxygène). On connaît
même des organismes (qualifiés de
microaérophiles) qui nécessitent une
concentration de dioxygène inférieure à
sa valeur dans l'air.
Les bactéries présentent ces 5 types
possibles, tout comme les unicellulaires. Les champignons
sont principalement aérobies sauf certains qui, comme
les levures, sont souvent aérobies facultatives. Les
plantes et les animaux sont presque tous aérobies
obligatoires.
Ces distinctions peuvent paraître complexes et sans
beaucoup d'intérêt au niveau des écoles
et pourtant il existe de nombreux mécanismes
accessibles au primaire où les bactéries ou
les unicellulaires anérobies interviennent. En voici
quelques exemples:
|
|
La conservation des
aliments par la technique des "conserves"
nécessite d'emprisonner dans une boïte en
métal hermétique les aliments à
conserver après avoir détruit les
micro-organismes à la chaleur. La durée et la
température de chauffage dépendent des
microorganismes que l'on désire tuer. Ainsi on
considère qu'il n'y a plus de spore de Clostridium
botulinum vivante après 2,5 min à
121°C (en supposant une population de départ de
l'ordre de 1000 milliards de spores...).
conditions approximatives de
stérilisation par la chaleur
humide
|
|
nom
|
forme vivante
|
forme de résistance (spores)
|
|
levures
|
5 min à 50-60°C
|
5 min à 70-80°C
|
|
moisissures
|
30 min à 62°C
|
30 min à 80°C
|
|
bactéries
|
10 min à 60-70°C
|
2 à plus de 800min à
100°C
0,5 à 12 min à 121°C
|
|
inactivation de virus
|
30 min à 60°C
|
en supprimant au maximum l'air (si un peu d'air est
emprisonné lors de la confection de la conserve il a
contenu de la vapeur d'eau à 100°C et on estime
que la plupart des micro-organismes ont été
tués). Les seules bactéries qui pourraient
encore se développer (SI LA BOÎTE N'EST PAS
ABÎMÉE ET OUVERTE ACCIDENTELLEMENT) sont des
bactéries anaérobies
|
quelques procédés de
conservation des aliments
|
|
principe
|
exemple de technique
|
|
diminuer la disponibilité en eau de
l'aliment pour que les organismes ne puissent pas
se développer
|
salage (ajout de sel)
|
|
ajout de sucre (confiserie)
|
|
élimination de l'eau
|
séchage
|
|
lyophilisation (séchage par pompage de
l'eau sous vide)
|
|
inactivation thermique, partielle ou totale des
micro-organismes
|
réfrigération,
congélation
|
|
pasteurisation
* LHT (low tempertaure holding): 62,8°C
prndant 30 min. (lait, bières, jus de
fruits...)
* HTST (high temperature short time): 71°C, 15
s
* UHT (ultra high temperature) 141°C, 2s:
lait
|
|
irradiation
|
UV (radiations ionisantes) ou RX
|
|
|
La fosse septique...voir page
sur l'eau
|
retour haut de page
Bulles (in E.U. article
"interface", voir aussi La mousse, François Graner, La
Recherche, 345, septembre 2001, 46-49)
Si de l'air barbote dans de l'eau, les bulles formées au sein
du liquide crèvent en arrivant à la surface; mais, si
l'eau contient un agent tensioactif, les bulles sont stables
et s'amassent pour former une mousse. Ces mousses sont
particulièrement stables dans le cas des savons qui donnent
des films suffisamment rigides et résistants.
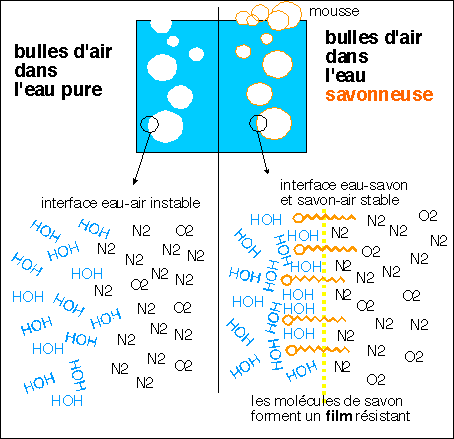
Les bulles sont stabilisées par le savon dont les
molécules forment un film résistant (voir
schématisation d'une molécule de savon
ci-dessous).
On appelle colloïde un mélange de deux fluides dont
l'interface est très grande et forme alors de petites
particules (environ 0,5 micromètres de diamètre). Ces
colloïdes sont soit des sols (dispersions de solides dans les
liquides - par exemple: les peintures; les boues), soit des
aérosols (dispersions de solides ou de liquides dans des
gaz - par exemple: le brouillard, les laques cosmétiques, les
fumées), soit encore des émulsions (qui sont des
dispersions de liquides dans des liquides - par exemple: le lait, la
mayonnaise). Les colloïdes sont instables et pour éviter
la séparation des phases on ajoute des "agents de
mouillage" qui diminuent l'énergie à l'interface
entre les deux fluides. Ce sont les stabilisants,
émulsionnants, tensioactifs, détergents ou
surfactants.
Ces agents de mouillage sont en général
formés d'une chaîne hydrocarbonée, la queue, et
d'une tête polaire ou ionique . La queue n'a pas
d'affinité pour les molécules d'eau de l'environnement,
elle est hydrophobe. La tête, par contre, agit fortement
avec de l'eau (interaction dipôle-dipôle ou
ion-dipôle) et elle est solvatée: elle est
hydrophile.
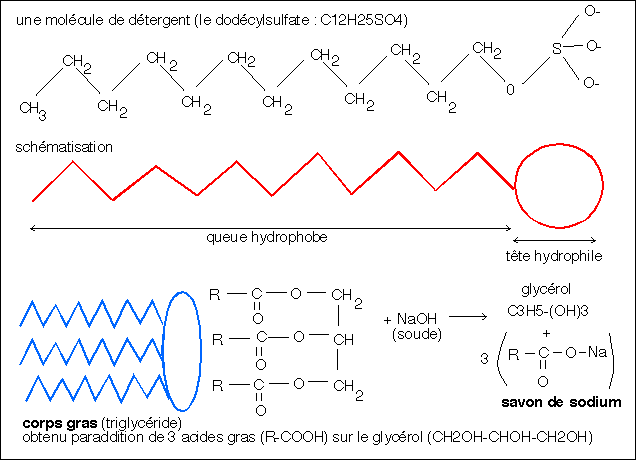
Détergents et savons sont des "agents mouillants" (voir
texte).
Le savon de Marseille est un savon de sodium, le savon noir, un savon
de potassium.
C'est cette différence entre la tête et la queue qui
confère au surfactant la propriété de s'adsorber
à une interface donnée pour diminuer la tension
superficielle. Par exemple, le produit tensioactif, s'il est
introduit dans un mélange eau-huile, va se placer de telle
sorte que les queues hydrophobes de ses molécules seront
repoussées par le liquide alors que les têtes
hydrophiles seront dans l'eau. Au repos, les liquides sont
séparés par densité, leur interface est plane,
et le détergent se fixe sur cette interface, la tête
vers l'eau . Si l'on agite l'ensemble et que la concentration en
détergent est suffisante (concentration micellaire critique),
il y a formation de gouttes entourées de surfactant
appelées micelles.
De façon générale, l'agent tensioactif se fixe
à l'interface du côté du liquide qui le mouille
le mieux. Dans le cas des savons, où la tête est large,
l'émulsion est constituée de gouttes d'huile dans l'eau
. De plus, s'il s'agit d'un savon de soude (un savon est un sel de
sodium d'acides gras obtenu par action de la soude sur l'acide gras),
la tête est ionisable (l'ion alcalin passe en solution) et
ainsi les gouttes chargées négativement se repoussent,
ce qui évite toute coalescence. En modifiant la nature et la
taille de la tête ou de la queue des molécules, il peut
se produire une inversion de l'émulsion: par exemple, les
forces agissant sur les queues peuvent tendre à
déformer l'interface jusqu'à la faire «se
retourner», on obtient alors des gouttes d'eau dans l'huile.
Un corps tensioactif peut également conférer à
un liquide un pouvoir mouillant vis-à-vis du solide s'il peut
s'y lier. C'est ainsi qu'un détergent, dont la queue
hydrophobe peut adhérer au tissu, va également se fixer
sur les particules de graisse déposées sur celui-ci.
Les têtes hydrophiles tendent à se repousser et ces
particules de graisse peuvent ainsi se détacher des tissus:
c'est le principe des lessives.
Pour traiter les eaux usées par exemple, on cherche à
déstabiliser ces films et à réaliser la
coalescence des bulles en neutralisant leurs charges négatives
par adjonction de cations (sels d'aluminium ou de fer): c'est la
floculation ou coagulation.
retour haut de page