atmosphère, effet de serre,
ozone...pollutions.
retour accueil
Les données qui suivent sont principalement extraites de
l'Encyclopedia Universalis ainsi que de "L'homme et le
climat", Jacques Labeyrie, Denoël, Point Sciences, 1985.
Un autre source très riche de documents est le site de l'ENS
Lyon : Planet-Terre en relation avec
les nouveaux programmes de SVT de seconde sur l'atmosphère
MAIS le niveau est assez élevé. Pour une entrée
en matière voir le dictionnaire: http://www.ens-lyon.fr/Planet-Terre/Infosciences/Dictionnaire/dico.htm
et les liens sur ces items (atmosphère, effet de serre,
ozone...).
L'atmosphère désigne l'enveloppe de la
terre, essentiellement gazeuse, la plus externe.
L'atmosphère est un fluide en mouvement. L'ensemble
constitué par le globe terrestre et son atmosphère se
comporte comme une machine thermique complexe : on peut
admettre qu'une source chaude unique se situe entre les tropiques et
que chaque région polaire constitue une source froide. Les
mouvements de l'atmosphère assurent les échanges
thermiques entre ces zones (mouvements de convection)
perturbés par la force de Coriolis due à la rotation de
la terre.
Structure
L'expérience et la théorie montrent que l'air a une
masse volumique toujours décroissante vers le haut, ce qui
revient à rejeter à l'infini la limite théorique
de l'atmosphère. On est ainsi conduit à
considérer que telle fraction de la masse totale de
l'atmosphère se situe au-dessous de telle altitude. Par
exemple, on peut affirmer qu'en moyenne la moitié de la masse
de l'atmosphère se situe au-dessous de 5 500 m; les
2/3 au-dessous de 8 400 m; les 3/4 au-dessous de
10 300 m; les 9/10 au-dessous de 16 100 m;
les 99/100 au-dessous de 31 000 m, etc. Les mesures
faites à 200 km (8,5.10-7 hPa) et 300 km
(8,8.10-8 hPa) correspondent au vide que l'on obtient en
laboratoire. On considère aujourd'hui que la hauteur limite de
l'atmosphère se situerait dans une zone de transition assez
épaisse, d'où les molécules pourraient
s'échapper vers l'espace sans que des chocs avec d'autres
molécules risquent de les renvoyer vers l'atmosphère.
Cette zone de transition se situerait entre 500 et 800 km.
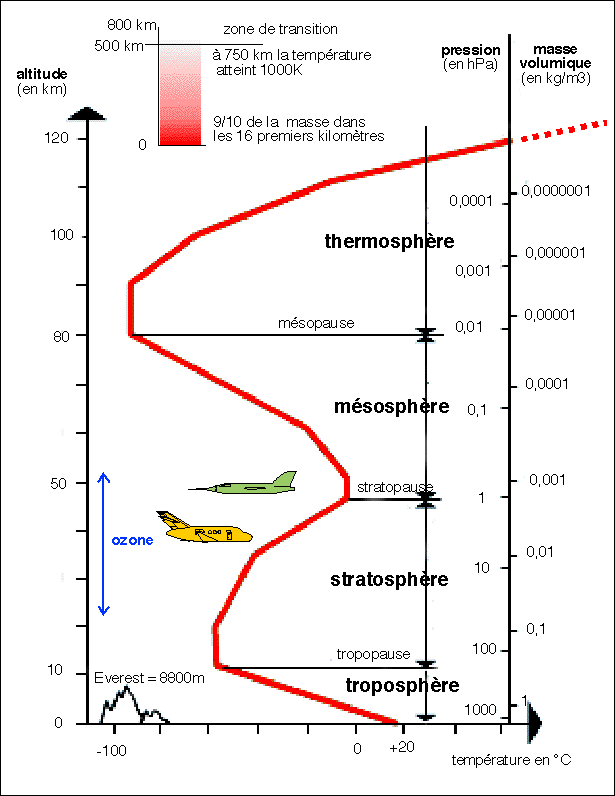
La structure verticale de l'atmosphère.
(pour des compléments voir le site Planet Terre: http://www.ens-lyon.fr/Planet-Terre/Atmosphere/structuratmosp.htm)
Effet de serre
L'effet de serre qui est le réchauffement de
l'atmosphère due à la réflexion des rayons
solaires renvoyés par la terre (voir ci-dessous) et
leur absorption par des gaz dits "à effet de serre" comme le
dioxyde de carbone. Si la teneur en dioxyde de carbone doublait on
peut estimer que la température à la surface de la
terre augmenterait d'environ 1,3 °C. La vapeur d'eau à un
effet complexe car c'est aussi un gaz à effet de serre mais
les nuages en réfléchissant les rayons solaires directs
diminuent aussi la température au sol.
Modèle
expérimental
Un montage avec un thermomètre placé sous une cloche de
verre est souvent proposé comme modèle de
l'atmosphère permettant de "monter" l'effet de serre. Il
paraît cependant judicieux, avant de les utiliser, de bien en
comprendre les limites (je vous conseille le livre de seconde de
Nathan, nouveau programme 1999):
* les montages qui font varier la nature du "sol" (papier noir ou
blanc) reposent sur des mesures d'albedo (pouvoir
réfléchissant du sol de l'ordre de 10% du rayonnement
reçu pour la végétation mais qui peut atteindre
80% de l'énergie reçue pour de la glace par exemple; il
faut en plus noter que les valeurs de la réflectance varient
bien sûr en fonction des longueurs d'onde .
* si l'on voulait vraiment faire un montage qui représente
plus précisément l'atmosphère, il faudrait faire
varier la teneur en dioxyde de carbone sous la cloche. Par exemple,
pour obtenir une atmosphère sans dioxyde de carbone on peut
utiliser des pastilles de potasse. Pour saturer l'atmosphère
en dioxyde de carbone on peut faire réagir du vinaigre sur du
bicarbonate de sodium. Mais il est à craindre que la
quantité d'air emprisonnée sous la cloche soit
très insuffisante pour que le phénomène soit
mesurable.
* on peut par contre considérer que c'est la cloche en verre
qui représente la couche des gaz à effet de serre (ne
pas confondre avec la couche d'ozone). Dans ce cas on fera
judicieusement une mesure avec et sans cloche (témoin). On
observe effectivement un écart mesurable. Deux
phénomènes interviennent au moins: d'une part les
infrarouges renvoyés par le "sol" sont partiellement
arrêtés (chauffent la cloche) et réfléchis
par la cloche (retournent vers le "sol"); ce phénomène
étant assez comparable à l'effet de serre par
"absorption-réflexion des IR"; mais d'autre part, l'air
chauffé est piégé par la cloche et ne peut pas
être renouvelé (pas de turbulences), ce qui est analogue
à ce que l'on obtient dans une serre de jardinier car c'est
essentiellement ce phénomène qui y est responsable de
l'augmentation de température qualifiée d'effet de
serre (voir encore une fois le site de Plante-Terre: http://www.ens-lyon.fr/Planet-Terre/
voir notamment le document de synthèse de Jean-François
Royer de Météo-France sur l'augmentation de l'effet de
serre et ses conséquences).
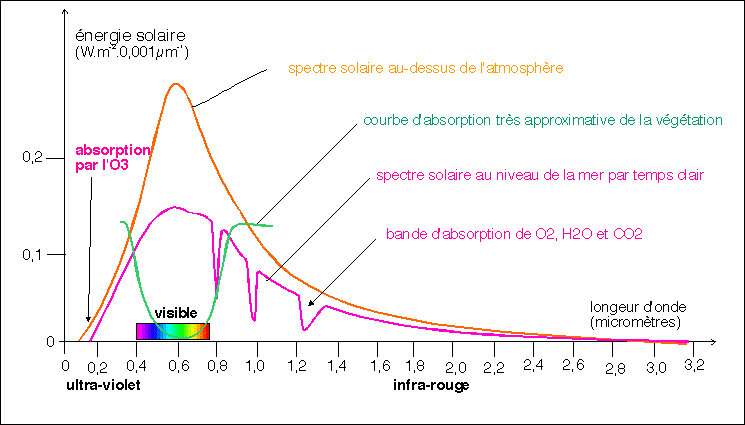
Cette courbe approximative du spectre solaire arrivant sur terre
permet de comprendre pourquoi la terre renvoie essentiellement des
infra-rouges (explication dans le texte)
L'atmosphère est une mince pellicule protectrice qui
absorbe de 25% à plus de 60% de l'énergie émise
par le soleil. Ce sont les molécules de dioxygène,
d'eau, de dioxyde de carbone et d'ozone qui en sont les causes
principales auxquelles il faut ajouter les aérosols de
poussières, de gouttelettes d'eau ou de glace (nuages) qui
peuvent faire encore chuter nettement l'énergie solaire
arrivant au sol. Le spectre (c'est-à-dire la
répartition selon la longueur d'onde) de cette énergie
solaire est presque totalement compris entre 0,2 et 3,2
micromètres (voir figure ci-dessus). On notera aussi que seul
l'ozone (O3) est capable d'absorber les rayonnements U.V. ce qui
confère un rôle protecteur à la couche d'ozone
atmosphérique (voir plus bas). Par temps très clair et
sans couche nuageuse une valeur de 2/3 de l'énergie solaire
arrivant au sol est sensée. On considère que 1% de
cette énergie incidente est récupérée par
les organismes photosynthétiques (grâce à leurs
pigments comme la chlorophylle).L'énergie
réémise par la terre dépend bien sûr de la
surface (eau, végétation, roche nue, désert...)
mais la terre absorbe une grande partie des longueurs d'onde du
spectre solaire et NE RÉÉMET PRINCIPALEMENT
QUE DES INFRA-ROUGES. qui sont justement les longueurs d'onde
les plus absorbées par le l'eau, le dioxyde de carbone,
l'ozone (molécules à plus de trois atomes : en effet le
dioxygène et le diazote ont des structures trop simples qui
n'absorbent que peu les infra-rouges) et les aérosols.
L'effet de serre est justement ce réchauffement de
l'atmosphère par le rayonnement infra-rouge
réémis par la terre.
Remarque: on notera que les CFC (voir plus
bas) sont aussi des gaz à effet de serre mais comme ils
détruisent l'ozone qui est lui-même un gaz à
effet de serre ils semblent peu intervenir dans le bilan global de
l'effet de serre.
Couches d'ozone
En ce qui concerne l'ozone atmosphérique, il faut
différencier (in, E.U.):
- La couche d'ozone strato-mésosphérique
qui est principalement causée par les rayonnement U.V.
solaires qui cassent la molécule de dioxygène. C'est
cette couche d'ozone qui est PROTECTRICE.
Elle nous protège des rayonnements U.V mais de par son
absorption d'énergie solaire elle réchauffe la haute
atmosphère (voir courbe de température ci-dessus).
O2 + particule de lumière (d'énergie > 5 eV) + O2
(ou N2) <-> 2 O° (atomes libres)+ 2O2 <-> 2O3 .
La destruction de l'ozone est réalisée d'une part
par le rayonnement solaire (photons d'énergie > 1,1 eV
produits en abondance lors des éruptions solaires) mais
aussi par des réactions avec les oxydes d'azote (voir
réactions ci-dessous) produits dans le moteurs d'avion ou
par des explosions nucléaires (ou encore les
éruptions solaires). Mais étant donné les
très nombreuses réactions chimiques en jeu, il est
pour le moins paradoxal que l'on considère que, à
l'altitude où vole le Concorde, ajouter des oxydes d'azote
conduit à augmenter la concentration de l'ozone.
« En 1974, Molina et Rowland démontrent que les
chlorofluorocarbures produits par l'homme
augmentent très sensiblement la quantité du chlore
(Cl) et des oxydes de chlore (ClO) dans la stratosphère.
Ces espèces chlorées peuvent elles aussi
détruire l'ozone, le chlore pouvant resservir des dizaines
de milliers de fois. Cependant, les oxydes de chlore interagissent
avec les oxydes d'azote et les oxydes d'hydrogène,
produisant plusieurs espèces, en particulier l'acide
chlorhydrique (HCl), le composé ClONO2 et bien d'autres
encore.
Il peut paraître surprenant que la production des CFC (moins
d'un million de tonnes par an en 1974, soit même pas
2 milligrammes par mètre carré en moyenne
globale) puisse avoir un effet notable, alors que le chlore
naturel ne manque pas (cristaux de sel des embruns, HCl dans les
exhalations des volcans, etc.). En fait, les formes "naturelles"
de chlore n'atteignent guère la stratosphère.
Comment les CFC y arrivent-ils? Ces molécules artificielles
ont la même structure de base que le méthane (CH4),
gaz naturel, mais avec des atomes de chlore ou de fluor (F)
à la place des quatre atomes d'hydrogène (H):
CF2Cl2, CFCl3, CCl4, etc. Les atomes de chlore ou de fluor se
lient très fortement à l'atome de carbone au centre
de la molécule, et, une fois liés, on peut
difficilement les en arracher. Les CFC sont donc chimiquement
inertes et présentent des risques d'inflammabilité
et de toxicité très faibles. Ces
propriétés, qui les rendent très attrayants
pour des usages domestiques, conduisent en même temps
à ce qu'aucune réaction ne les détruit dans
la troposphère, et ils finissent par atteindre la
stratosphère. Là, ils rencontrent des photons du
rayonnement U.V. solaire suffisamment énergétiques
pour les dissocier, libérant du chlore et du fluor. On
craignait donc, dès la fin des années 1970, que le
flux grandissant des CFC vers la stratosphère ne renforce
le cycle de destruction catalytique de l'ozone. Les
inquiétudes suscitées par les travaux de Molina et
Rowland n'ont pas convaincu tous les scientifiques, ni les
industriels fortement intéressés à l'usage
des CFC. Les résultats des calculs sont très
sensibles aux réactions chimiques prises en compte,
impliquant souvent des espèces extrêmement difficiles
à observer en laboratoire. De même, il est
très difficile de mettre en évidence l'effet des
CFC, alors que la couche d'ozone varie fortement au cours de
l'année et dépend de l'activité solaire.
Néanmoins, alarmé par les rapports parus dans les
médias, le public prend peur, refusant d'acheter les bombes
à aérosols qui utilisent les CFC comme propulseurs.
L'interdiction dès 1978 de cette utilisation des CFC (aux
États-Unis et en Suède) ne fait qu'entériner
le choix du public. Toutefois, leur emploi dans l'industrie du
froid se multiplie; en 1985, la production mondiale dépasse
le million de tonnes. Sur ce fond de controverses hautement
techniques, difficiles à appréhender par le public
et les politiques, l'annonce en 1985 de la découverte du
trou dans la couche d'ozone fait l'effet
d'une bombe. Selon les mesures effectuées par Joseph Farman
et ses collaborateurs à la station scientifique britannique
de Halley Bay, plus de la moitié de l'ozone au-dessus de
l'Antarctique disparaît pendant le printemps austral. Ces
conclusions sont confirmées par des mesures provenant
d'autres stations de l'Antarctique, parfois fort
éloignées, notamment la station japonaise de Syowa.
Certes, la quantité d'ozone remonte en été,
mais le changement de comportement de la stratosphère est
radical. Ce changement était si peu attendu que le
système de traitement des données du
spectrophotomètre T.O.M.S. (Total Ozone Mapping
Spectrometer) de la N.A.S.A., surveillant la quantité
d'ozone à partir du satellite Nimbus-7 (lancé
en 1978), avait rejeté les valeurs "trop" faibles, les
attribuant à des erreurs de l'instrument. Après la
publication des résultats de Farman, les chercheurs de la
N.A.S.A. ont réexaminé ces données, mettant
en évidence le développement du trou à chaque
printemps depuis 1979 et l'extension de la région
affectée à l'ensemble de l'Antarctique. Comment
comprendre ce changement radical de la chimie de la
stratosphère? Fallait-il y voir l'impact des CFC? Tout le
monde n'était pas prêt à l'admettre. En
l'absence d'observations systématiques menées en
Antarctique avant l'Année géophysique internationale
(1957), on ne pouvait être sûr que le trou fût
sans précédent. Pourquoi l'Antarctique d'ailleurs,
alors que l'on n'observait point de trou sur l'Arctique (en 1985)?
Et comment tenir compte des réactions chimiques sur les
surfaces des aérosols volcaniques ou autres? Ces
questions ont donné lieu à une intense
activité de recherche et à l'organisation
d'ambitieuses campagnes internationales d'observation, d'abord en
Antarctique, puis dans l'hémisphère Nord. La
première, la campagne Noze 1 (National Ozone
Expédition), est organisée sous l'égide de la
National Science Foundation des États-Unis pendant l'hiver
et le printemps austraux (principalement d'août à
octobre) de 1986 et dirigée par la jeune chimiste
américaine Susan Solomon. Mobilisant plusieurs avions de
recherche (dont l'ER-2, version civile de l'avion espion U-2
pouvant voler à 20 000 m d'altitude),
lâchant des dizaines de ballons de recherche de
différentes stations, analysant des échantillons
d'air à différentes altitudes, ces campagnes
viennent compléter les mesures ponctuelles faites depuis le
sol et les données fournies par les satellites. La
concentration de l'ozone ainsi que celles de toutes les
espèces - chlorées, azotées,
hydrogénées - pouvant affecter son abondance
sont mesurées. Les aérosols, les températures
et les vents sont aussi étudiés.
Plusieurs facteurs expliquent l'apparition du trou au sud
plutôt qu'au nord. Au-dessus de l'océan Arctique,
entouré par des masses continentales aussi bien que par des
océans, la circulation atmosphérique est fort
irrégulière, alternant réchauffements
brusques et épisodes très froids, mélangeant
souvent l'air polaire avec l'air des latitudes moyennes. En
revanche, au pôle Sud, entouré de milliers de
kilomètres d'océan, l'Antarctique connaît une
circulation très régulière. En hiver (de juin
à août), lorsqu'il ne reçoit aucun rayonnement
solaire, les températures sont très basses et les
vents d'altitude s'organisent en un immense tourbillon stable
appelé le vortex polaire. La stratosphère
au-dessus de l'Antarctique, alors isolée du reste de
l'atmosphère, devient un énorme vase clos de
réactions chimiques. Avec des températures
inférieures à - 85 °C, les nuages
stratosphériques polaires se forment.
Le rôle critique des CFC anthropiques est
confirmé: la concentration de l'ozone diminue surtout
là où celle du chlore et du monoxyde de chlore est
la plus forte. Il s'agit bien de chlore anthropique, car on le
trouve associé à du fluor sous des formes qui sont
extrêmement rares dans le milieu naturel. Cependant, le
cycle de réactions qui agit n'est pas celui qui
était proposé en 1974, car des réactions
beaucoup plus efficaces ont lieu en présence des particules
de nuages. Ces particules, cristaux de glace d'eau et d'acides
chlorhydrique et nitrique, permettent des réactions qui
libèrent le chlore, notamment sous la forme Cl2, alors que
les espèces azotées qui pourraient en quelque sorte
neutraliser ce chlore se trouvent séquestrées dans
les particules suffisamment lourdes pour quitter la
stratosphère ("sédimenter"). L'été,
les températures remontent et le vortex polaire se
disloque. Le trou se comble par le mélange de l'air pauvre
en ozone avec le reste, mais cela dilue progressivement l'ozone
des autres latitudes.
Le caractère spectaculaire des cartes du trou dans la
couche d'ozone et la théorie élaborée par les
scientifiques rendant responsables les CFC anthropiques ont
convaincu le public ainsi que les décideurs industriels et
politiques de la nécessité d'agir. Dès
1986, l'industrie chimique intensifie la recherche de produits de
remplacement des CFC. En septembre 1987, quarante-trois pays
signent le protocole de Montréal, qui (faisant
référence à la convention de Vienne de 1985)
programme une réduction par étapes de la production
des CFC. En mars 1988, un "panel" d'experts conclut à une
perte réelle de 2 à 3 p. 100 de l'ozone sur
l'ensemble de l'hémisphère Nord. Après la
ratification du protocole en 1988, la société
chimique américaine Du Pont de Nemours, qui
fabriquait le quart des CFC produits dans le monde, annonce
l'arrêt progressif de leur production.
Chaque année depuis 1987, la destruction de l'ozone
s'étend au-dessus de l'Antarctique sur plus de
20 millions de kilomètres carrés (deux fois la
taille de l'Europe). En 1995, le phénomène a
commencé dès la fin de juillet et a duré
jusqu'à la fin de novembre. Malgré la disparition
progressive depuis 1993 des aérosols dus à
l'éruption du Pinatubo, plusieurs records ont
été battus, aussi bien pour la durée de la
saison de destruction que pour la rapidité de l'expansion
du trou. Le taux de destruction a atteint 1 p. 100 par jour
pendant tout le mois d'août; en septembre, plus de 60
p. 100 de l'ozone situé entre 14 et 20 km
d'altitude avaient disparu au-dessus de trois stations
antarctiques, en octobre plus de 80 p. 100.
Certes, ce trou se comble à la fin du printemps, en
décembre, mais ses effets se propagent à
l'échelle du globe. Depuis 1982, l'ozone
stratosphérique en dehors de la zone tropicale a
diminué de 6,5 p. 100 en moyenne au-dessus de
l'hémisphère Nord et de 9,5 p. 100 au-dessus de
l'hémisphère Sud. Les effets des CFC se font
maintenant menaçants au nord, surtout lorsque les
températures dans la stratosphère sont
particulièrement basses. Entre janvier et mars 1995, on a
observé une diminution de 10 p. 100 et même de
35 p. 100 de l'ozone au-dessus de la Sibérie. Que nous
réservent les prochaines années? Bien que la
production des CFC ait pratiquement cessé, ces
molécules continuent d'arriver dans la stratosphère.
La perturbation se poursuivra pendant quelques décennies
encore. Le trou de l'ozone de l'Antarctique se formera sans doute
encore plus rapidement au printemps; au-dessus de l'Arctique, les
"minitrous" observés dans la couche d'ozone risquent de
s'agrandir encore. Chaque été, le mélange de
l'air du vortex avec l'air des moyennes latitudes diminuera un peu
plus la quantité totale d'ozone, peut-être jusqu'en
2030. Le débat sur les risques et avantages de tel ou tel
produit de substitution se poursuit, avec les chlorofluorocarbures
hydrogénés (HCFC) et les hydrofluorocarbures (HFC)
d'une part, avec les produits contenant du brome d'autre part. Il
semble pourtant que, si l'on devait découvrir demain un
moyen d'éliminer d'un coup, directement dans la
stratosphère, tous les composés chlorés et
bromés, l'ozone perdu depuis les années 1970 se
reconstituerait en quelques mois. Cela étant fort
invraisemblable, la stratosphère des prochaines
décennies, voire du prochain siècle, restera
appauvrie en ozone. Avec quelles conséquences?
Réduire l'ozone, c'est réduire l'absorption du
rayonnement U.V. du Soleil qui réchauffe la
stratosphère. Avec une stratosphère plus froide, la
circulation de l'atmosphère, la propagation des
perturbations se trouveront-elle modifiées? Nous n'avons
guère d'éléments de réponse. Nous
nous inquiétons surtout d'une éventuelle
augmentation du rayonnement U.V. arrivant au sol. Celle-ci
s'observe effectivement en Antarctique. Ailleurs, les mesures
systématiques manquent, et aujourd'hui des réseaux
de stations pour mesurer l'U.V. au sol se mettent en place. Le
calcul montre que ce rayonnement doit augmenter si rien d'autre ne
change, mais en fait tout change; en particulier, les
activités humaines modifieraient le climat en augmentant
d'une part les aérosols et d'autre part le CO2 et autres
gaz à effet de serre dans l'atmosphère. Si ces
émissions changent le climat, et notamment la couverture
nuageuse, elles peuvent aussi affecter le rayonnement U.V.
arrivant au sol autant que la diminution de l'ozone.
Si le rayonnement U.V. augmente, quelles seront les
conséquences pour la vie? Il est certain que trop
d'exposition aux rayons U.V. peut entraîner des cancers de
la peau. On constate effectivement une augmentation de ces
cancers. Est-elle due entièrement à une augmentation
du rayonnement U.V. à la surface de la Terre? Ne faut-il
pas prendre en compte aussi les facteurs sociologiques (davantage
de vacanciers à Tenerife...)? Quelles seront les
conséquences écologiques, notamment aux latitudes
élevées où les phytoplanctons pourraient se
révéler sensibles aux rayons U.V.? À vrai
dire, là aussi, les observations hors laboratoire sont peu
nombreuses, et certains calculs pourraient sous-estimer la
capacité d'adaptation de la vie... Bref, en arrêtant
la fabrication des CFC, avons-nous évité une
catastrophe? Il est difficile d'en être parfaitement
sûr. »
- l'ozone de la troposphère qui est une
POLLUTION atmosphérique due à
l'activité humaine (elle est beaucoup plus faible que la
concentration en ozone de la couche supérieure). C'est
encore la lumière mais avec les longueurs d'onde du domaine
visible qui est susceptible de casser des molécules
oxygénées présentes dans l'atmosphère
(plus fragiles que le dioxygène): par exemple le dioxyde
d'azote (NO2 ou oxyde nitreux), produit par les moteurs à
explosion (automobiles). Aujourd'hui, à l'échelle
planétaire, l'homme est la cause directe d'au moins 60 %
des émissions de NO2 (et CO).
NO2 + particule de lumière (photon) d'énergie
supérieure à 2,9 eV + O2 <-> O + NO + O2
<-> O3 + NO
L'ozone sert d'oxydant très fort de
l'atmosphère (oxyde le CO en CO2...) et ce n'est que dans
des grandes villes ensoleillées et à fort trafic
automobile que l'on peut atteindre des concentrations de la basse
atmosphère en ozone qui soient sensibles (picotement des
yeux, maux de gorge). On notera que la nuit, la production cesse
étant donné l'absence de lumière (seules
subsistent les réactions de destruction). L'ozone sert
aussi d'oxydant-stérilisant pour les eaux des piscines par
exemple.
Pour des discussions récentes voir encore une fois le site
Planet-Terre: http://www.ens-lyon.fr/Planet-Terre/Structure-atm/Ozone/OzoneCFCs.htm
Autres pollutions
|
Définition donnée en 1965 par le
Comité scientifique officiel de la Maison-Blanche
pour la protection de l'environnement :
«La pollution est une
modification défavorable du milieu naturel qui
apparaît en totalité ou en partie comme le
sous-produit de l'action humaine, au travers d'effets
directs ou indirects altérant les modalités de
répartition des flux d'énergie, des niveaux de
radiation, de la constitution physico-chimique du milieu
naturel et de l'abondance des espèces vivantes. Ces
modifications peuvent affecter l'homme directement ou au
travers des ressources en produits agricoles, en eau, et
autres produits biologiques. Elles peuvent aussi l'affecter
en altérant les objets physiques qu'il
détient, les possibilités
récréatives du milieu ou encore en
enlaidissant la nature.»
D'autres définitions, plus restrictives, limitent
l'usage du terme de pollution au rejet de produits chimiques
ou radioactifs dans l'environnement et désignent sous
le vocable général de
nuisance les autres altérations
du milieu ambiant provoquées par l'homme (on parlera
alors, par exemple, de nuisance sonore ou de nuisance
esthétique...). François
Ramade in E.U.
|
On estime que les gaz représentent 90% des polluants alors que
les particules représenteraient les 10% restants.
*Les gaz rejetés dans l'atmosphère par
l'activité humaine et constituant une pollution ne sont pas
toujours dangereux directement mais sont à l'origine de
nombreuses réactions chimiques qui donnent naissance à
des substances autrement toxiques.
- L'exemple le plus classique en est certainement
l'anhydride sulfureux (SO2) qui est un gaz
d'échappement des moteurs thermiques et qui va s'oxyder
dans l'air en SO3, lequel, à son tour, donnera, avec la
vapeur d'eau, de l'acide sulfurique. Il contribuera ainsi, de
façon déterminante, avec l'acide nitrique
formé à partir des oxydes d'azote, à
l'apparition du phénomène des pluies acides
(responsables du dépérissement à vaste
échelle des forêts de conifères, et de
l'acidification des eaux des lacs situés sur terrains
cristallins), et d'une façon plus générale
à la formation des
smogs acides, brouillards propres
aux milieux urbains des régions à climat
tempéré froid où sévit une forte
pollution de l'air. La pollution de l'air par le SO2 est
particulièrement néfaste pour les
végétaux. Les lichens présentent une telle
sensibilité qu'on les utilise comme indicateurs
biologiques de pollution de l'air. Aucune espèce de
lichen ne peut survivre à une concentration
supérieure à 35 ppb dans l'air (ppb = partie
par milliard = 10-9: à Paris, la teneur
moyenne annuelle de SO2 au début des années 1990
était de 35 mg/m3 d'air), ce qui explique leur
disparition des parcs situés au centre des villes. Le SO2
est également fortement toxique pour les plantes à
fleurs, aucune plante supérieure ne pouvant croître
normalement dans un air qui renferme en permanence plus de
80 ppb de SO2. Même chez les végétaux
très résistants, des lésions foliaires
apparaissent après à peine une demi-journée
d'exposition à 0,25 ppm (ppm = partie par million
= 10-6) de ce gaz. Elles se caractérisent
par une nécrose internervaire et bifaciale du limbe
foliaire qui prend une coloration variable, souvent de teinte
ivoire.
Parmi les arbres forestiers, les conifères
présentent une sensibilité particulière au
SO2 bien que les espèces à feuilles caduques soient
aussi affectées.
Les animaux et l'homme souffrent également de la pollution
de l'air par le SO2. Sa toxicité chez les Mammifères
se traduit par une diminution de l'élasticité
pulmonaire à des concentrations inférieures à
1 ppm et au-delà par une hypersécrétion
bronchique.
Le SO2 agit de façon synergique à la fumée de
tabac dans l'induction chez l'homme de la bronchite chronique et
de l'emphysème pulmonaire .
- Les oxydes d'azote , quoique toxiques pour les
végétaux et les animaux aux fortes concentrations,
constituent une catégorie importante
d'aéropolluants, surtout à cause de leurs effets
indirects. Ils se transforment en effet en des composés
très dangereux, les peroxyacylnitrates (PAN) dans les
atmosphères urbaines polluées et
ensoleillées, propices à la formation des smogs
photochimiques. Ces dernières sont le siège de
diverses réactions conduisant à la formation
d'ozone, lequel va à son tour agir sur d'autres polluants,
les hydrocarbures imbrûlés, qu'il oxyde en
peroxyacycles. La réaction de ces derniers avec les oxydes
d'azote produit des PAN, lesquels sont particulièrement
toxiques à la fois pour les végétaux et les
animaux: 15 ppb de ces substances suffisent pour provoquer en
quatre heures des brûlures foliaires chez les
phanérogames, une dizaine de ppb induit une forte
irritation des muqueuses oculaires et bronchiques des
Mammifères alors que les taux de PAN supérieurs
à 50 ppb sont par exemple relevés
régulièrement dans diverses villes
californiennes.
- Les effets de l'exposition aux aéropolluants gazeux
(SO2, oxydes d'azotes, PAN, ozone, etc.) et/ou aux
précipitations acides sont à l'origine de
sérieux dommages à la végétation, en
particulier dans les écosystèmes forestiers qui
présentent, dans l'ensemble des pays industrialisés
depuis la fin des années 1970, divers signes de
dégénérescence. En Europe occidentale et
centrale, dans le nord-est de l'Amérique du Nord, les
boisements de conifères sont particulièrement
affectés.
À la fin des années 1980, on estimait que de 1
à 4 p. 100 des arbres des forêts feuillues et
jusqu'à 8 p. 100 de ceux des forêts de
résineux étaient morts dans les divers pays
d'Europe. La proportion d'arbres affectés par les pluies
acides et autres aéropolluants dépassait 50
p. 100 dans les forêts de conifères de la
quasi-totalité de ces pays, sauf dans celles de la
péninsule Ibérique.
- Les dérivés fluorés
constituent une autre catégorie importante de polluants
atmosphériques.
Les fluorures sont rejetés dans l'air par diverses
industries, surtout celle de l'électrochimie de l'alumine.
La contamination des sols qui en résulte s'avère
catastrophique pour de nombreuses plantes cultivées ou
spontanées et pour les forêts de conifères. De
plus, elle s'accompagne d'une concentration du fluor dans les
chaînes alimentaires des animaux domestiques et de l'homme.
En France, dans la vallée de la Maurienne et sur le plateau
de Lannemezan, où sont implantées des usines qui
produisent de l'aluminium, les bovins sont atteints de fluorose,
affection caractérisée par des déformations
osseuses puis une cachexie fatale.
Les chlorofluorocarbures, encore dénommés
Fréons , sont des dérivés
chlorofluorés du méthane et de l'éthane
chimiquement inertes, utilisés comme gaz
réfrigérant ou propulseur dans les bombes
aérosols. (voir ci-dessus: couches d'ozone)
- Dérivés du carbone
Les hydrocarbures imbrûlés constituent des
contaminants prépondérants dans les
atmosphères polluées des grandes
agglomérations; certains d'entre eux sont des polluants
secondaires qui se forment dans les combustions
incomplètes. Tel est le cas des hydrocarbures polycycliques
carcinogènes: benzopyrène, benzanthracène,
fluoranthrène, etc., qui sont particulièrement
abondants dans les fumées, les suies et les
échappements de moteurs (diesels notamment).
L'oxyde de carbone (CO), également produit par les
combustions incomplètes, représente le principal
polluant de l'air (en masse). Il se rencontre usuellement à
des teneurs comprises entre 20 et 40 ppm dans les
atmosphères urbaines polluées, le seuil de
toxicité étant fixé à 100 ppm. Il
s'agit d'un toxique respiratoire très puissant qui bloque
la fixation de l'oxygène par l'hémoglobine en se
combinant à cette dernière de façon
irréversible.
Le gaz carbonique (CO2), bien qu'il soit un constituant
normal de l'atmosphère, est rejeté dans l'air en
quantités considérables par suite de l'usage des
combustibles fossiles.
En 1993, on estimait que les combustions avaient rejeté
quelque 6,4 milliards de tonnes de CO2 (en équivalent
carbone) dans l'atmosphère; en 1960, les quantités
produites atteignaient 10,5 milliards de tonnes, en 1990,
23 milliards de tonnes.
En conséquence, on observe une croissance continue de la
teneur de l'air en CO2, au rythme actuel de 1,5 ppm par an.
Les mesures effectuées à l'observatoire de Mauna Loa
(Hawaii) et l'étude des bulles d'air emprisonnées
dans les calottes polaires montrent que la concentration est
passée d'environ 270 ppm dans les années 1850
(début de la civilisation industrielle) à
357 ppm en 1993. La civilisation technologique a donc
déjà perturbé le cycle du carbone à
l'échelle globale. En outre, cette augmentation de la
teneur en CO2 atmosphérique est susceptible de provoquer
d'importantes modifications climatiques. Le CO2 est responsable
d'un effet de serre en retenant au voisinage du sol les
rayonnements infrarouges, calorifiques . Tout accroissement de sa
concentration atmosphérique induit automatiquement un
réchauffement des basses couches de la troposphère.
On a pu calculer qu'un doublement de sa teneur dans l'air pourrait
augmenter de 2,8°C la température moyenne
superficielle de la Terre (actuellement de 15 0C).
Simultanément se produirait une baisse moyenne des
précipitations de l'ordre de 15% dans deux bandes
comprises, d'une part, entre 300 et 550 N et, d'autre part,
entre l'équateur et 200 S. Selon certains experts du
climat global, le réchauffement général et
les autres modifications climatiques associées à
cette augmentation de la teneur de l'atmosphère en CO2 sont
déjà perceptibles.
* Particules solides
On les classe en catégories de taille décroissante, les
plus petites, dites insédimentables, car incapables de se
déposer au sol sous l'effet de la gravitation,
possèdent un diamètre inférieur à
0,1 micron. Ce sont les plus dangereuses pour la santé
humaine car elles sont susceptibles de pénétrer dans
les alvéoles pulmonaires. Par ailleurs, elles contaminent les
plus hautes couches atmosphériques et sont donc responsables
d'une pollution globale.
Deux types de «particules» soulèvent des
problèmes d'hygiène publique des plus
préoccupants en milieu urbain, celles qui dérivent du
plomb ou de l'usage des fibres
d'amiante .
Utilisés comme additif des supercarburants, divers
composés plombiques sont transformés par les
combustions en particules de plomb généralement
insédimentables. On détecte couramment dans l'air des
grandes villes européennes des concentrations de plomb
particulaire égales ou supérieures à
5 microgrammes par mètre cube alors que le taux maximal
réputé non toxique pour l'homme est de l'ordre de
0,7 mg/m3.
L'amiante est un matériau isolant et ignifuge qui a
été fort utilisé dans les industries
métallurgiques et dans le bâtiment, avant d'être
interdite dans de nombreux pays (dont la France, le 1er janvier
1997). L'inhalation des fibres d'amiante polluant l'atmosphère
induit une affection redoutable, le mésothéliome
pulmonaire.


