traduction du court article de
vulgarisation paru dans Science
in School n°7: texte
original en
vert dans la colonne de droite -
(commentaires en
bleu) - remarques
générales en bas de
page

la migration des gnous
(image
pas de droits connus)
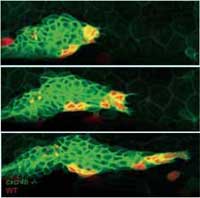
Vidéo(0) d'un amas
de cellules primordiales du poisson-zèbre en cours de
migration. Elles formeront la ligne latérale (organe
sensitif sensible à la pression). Chaque cellule fait
environ 10 µm de diamètre. La vitesse de
migration est de l'ordre de ~ 66 µm/h à
25°C. Chaque prise d'image est séparée
d'environ 30s. Il y a 45 images. La totalité de la
prise d'image dure 22,5 min. Dans cette vidéo,
accélérée environ 210 fois, il y a 7
images par seconde soit 6,42s de film.
(0)
Ceci est une
prouesse technique :
Pour marquer les cellules on doit d'abord obtenir une
lignée embryonnaire génétiquement
modifiée qui exprime la protéine fluorescente
GFP (lignée transgénique CldnBGFP ). On
injecte ensuite aux embryons de cette lignée un
promoteur (séquence activatrice) d'un gène de
la protéine Claudin B qui intervient dans les
jonctions serrées et est transcrite en grande
quantité dans les cellules de la ligne
latérale que l'on désire
marquer.(voir
annexe)
Laura Spinney (*??) explore la migration des cellules et la formation des organes à l'aide du poisson-zèbre, fin et transparent.
*probablement la journaliste qui écrit cet article... aucun moyen de la contacter dans la revue....le chercheur plus ou moins interviewé (?) ici est plus accessible.
Submitted by sis on Sun,
2007-12-09 19:07
Why are cells like
wildebeest? Laura Spinney investigates the migration of
cells and the formation of organs, using the tiny and
transparent zebrafish.
(1) génétiquement programmées : cette référence conventionnelle scolaire au programme génétique n'est pas en accord avec ce qui suit... tous les résultats de l'article tendent justement à nous faire sortir de ce carcan
Chaque année en mai de grandes hordes de gnous se déplacent depuis les plaines sèches de l'Est africain vers les forêts à la recherche de nourriture. Ils reviennent en novembre, quand les faibles pluies arrosent à nouveau la plaine, terminant ainsi leur migration annuelle. Chaque gnou se comporte selon son instinct de survie, qui le pousse à rechercher la compagnie des autres gnous. Une fois qu'une horde est formée, elle se comporte comme une nouvelle unité, avec ses propres règles. Les cellules ont le même instinct de groupe. Elles sont génétiquement programmées(1) pour travailler avec d'autres cellules, mais il n'y a pas d'ensemble figé d'instructions qui détermine un comportement précis pour chaque cellule d'un embryon. « Nous nous rendons compte maintenant que de nombreux événements qui arrivent après la fécondation sont en quelque sorte libres, plastiques, et basés sur des principes d'auto-organisation» dit Darren Gilmour du Laboratoire Européen de Biologie Moléculaire (EMBL) d'Heidelberg, en Allemagne.
En tant que biologiste du développement Darren souhaiterait comprendre ces principes faisant qu'une masse de cellules en migration parvient à donner naissance à une sculpture de systèmes complexes et intriqués comme ceux des vaisseaux sanguins ou du système respiratoire. Comme les cellules , dans ces groupes en migration, semblent être identiques vis-à-vis des gènes exprimés, le fait de supprimer (inactiver) ou d'inactiver (réduire l'activité) de certains gènes conduit à stopper la migration de tout le groupe. Il doit alors utiliser une approche plus subtile, en cherchant des moyens de rompre le réseau social cellulaire et en observant comment ceux-ci affectent leur capacité à migrer et à construire des organes. « C'est fondamentalement social» dit-il. « Nous voulons savoir qui dit à qui de faire quelque chose et comment il le dit ».
Every year in May, vast herds of wildebeest move from the dry East African plains towards the forests in search of food. They return in November, when the short rains come to water the plain, thus completing their annual migration. Each wildebeest behaves according to its instinct for survival, which tends to push it towards the company of other wildebeest. Once a herd has formed, it behaves as a new unit, with its own rules. Cells have a similar herd instinct. They are genetically programmed to work with other cells, but there is no strict set of instructions that determines the precise behaviour of every cell in the group. "We realise now that many of the events that occur after fertilisation are somehow free and plastic, and based on self-organising principles," says Darren Gilmour from the European Molecular Biology Laboratory in Heidelberg, Germany.
As a developmental biologist, Darren would like to understand those principles, because the mass migration of cells gives rise to the sculpting of intricate and complex systems such as blood vessels and the respiratory system. Since the cells within these migrating groups appear to be very similar in terms of the genes they express, knocking out (inactivating) or knocking down (reducing the activity of) single genes tends to block migration in the whole group. He has to take a more subtle approach, finding ways to disrupt the cells' social networks, and looking at how that affects their ability to migrate and build organs. "It's sociology, basically," he says. "We want to know who tells who what to do, and how."
The microscope image of a transparent zebrafish embryo shows
the lateral line primordium under the skin of the animal. It
starts behind the ear, moving towards the tail, and leaves a
trail about two cells thick, punctuated by little clusters
of cells that will eventually become hair cell organs as
shown in the box to the right.
Image courtesy of Darren Gilmour, EMBL
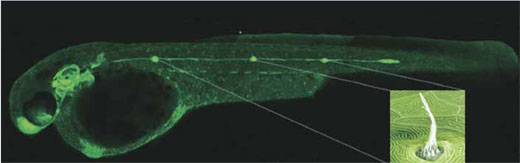
Image microscopique d'un
embryon de poisson-zèbre transparent montrant le
primordium de la ligne latérale sous la peau de
l'animal.

poisson-zèbre
(photo station de
Villefranche-sur-mer)
(2) primordium = ensemble de cellules embryonnaires (primordiales) ayant un devenir commun
(3) mutant = voir annexe
Le groupe de Darren explore ces principes au niveau du primordium(2) de la ligne latérale du poisson-zèbre, une structure transitoire qui ne peut être vue qu'au début du développement, et dont la fonction est d'équiper le poisson-zèbre d'organes contenant des cellules ciliées - organes sensitifs qui lui permettent de détecter la présence d'autres poissons au moindre changement de la pression de l'eau. «Le primordium est un amas de plus de 100 cellules qui rampent sous la peau de l'animal comme une limace» explique Darren. « Il commence derrière l'oreille, se déplace en direction de la queue, et laisse une traînée d'environ deux cellules d'épaisseur, ponctuée de petits amas de cellules qui deviendront éventuellement des organes à cellules ciliées».
En tant que système vivant modèle, le poisson-zèbre est la réponse aux prières des biologistes, du fait de sa transparence et donc du confortable suivi visuel des cellules marquées par des protéines fluorescentes (0). Le système de la ligne latérale est relativement facile à concevoir génétiquement, et est aussi en quelque sorte un cadeau pour ceux qui s'intéressent à la migration des cellules., parcequ'il utilise des mécanismes de signalisation très importants dans la santé humaine et donc très étudiés. Un signal chimique nommé SDF1, l'équivalent chez le poisson-zèbre d'un signal que l'on trouve chez les humains, provoque une série de changements dans les cellules primordiales en se fixant à un récepteur appelé Cxcr4b que la cellule possède à sa surface. Cxcr4b est une protéine qui traverse la membrane cellulaire. Elle est notamment nécessaire à l'infection du VIH chez l'homme. En plus de son rôle dans le développement elle est aussi impliquée dans les métastases et la dispersion des cellules tumorales.
L'équipe de Darren a montré que, chez un mutant(3) de poisson-zèbre chez qui le signal Cxcr4b est réduit, le primordium perdait son orientation directionnelle - il n'y a plus de mouvement en avant et le primordium ne laisse plus de traînée de cellules en arrière. De plus, la structure devenue statique, semble cesser de produire de nouveaux amas de cellules. Un des traits les plus surprenants chez ce mutant est que, bien que la migration du primordium soit stoppée, une observation fine montre que ses cellules bougent encore, se heurtant les unes aux autres de façon apparemment désordonnée.
Pour essayer de "soigner" le mutant (3) et de restaurer la progression du primordium, les chercheurs ont fabriqué une mosaïque génétique en transplantant des cellules normales, qui expriment le récepteur Cxcr4b, et peuvent donc répondre au signal SDF1a, à l'intérieur d'un tissu "mutant". Les cellules normales et "mutées" furent marquées en rouge et en vert respectivement afin de pouvoir les suivre (0). Très rapidement, et ce malgré le mouvement désordonné des cellules dans le primordium, les cellules sensibles au signal trouvent leur chemin vers l'avant et le primordium reprend sa progression.
Darren's group explores these principles in the lateral line primordium of the zebrafish, a transient structure that can only be seen in early development, and whose function is to equip the embryonic fish with hair cell organs &endash; sensory organs which enable it to detect the presence of other fish based on minute changes in water pressure. "The primordium is a cluster of more than 100 cells which creeps along under the skin of the animal, like a slug," Darren explains. "It starts behind the ear, moving towards the tail, and as it goes it leaves a trail about two cells thick, punctuated by little clusters of cells that will eventually become hair cell organs."
As model systems go, the zebrafish is an answer to biologists' prayers, as it is transparent and therefore amenable to live imaging of cells which have been labelled with fluorescent proteins. The lateral line system is relatively easy to engineer genetically, and it is also a gift to those interested in cell migration, because it makes use of a signalling pathway that is very important in human health, and therefore well studied. A chemical signal called SDF1, the zebrafish equivalent of a signal also found in humans, causes a range of changes in the primordium cells. It does so by binding to a receptor, called Cxcr4b, that the cells carry on their exterior. Cxcr4b is a protein which sits across the cell membrane and, in humans, is necessary for HIV infection. As well as playing a role in normal development, it is also implicated in metastasis, or the spread of tumour cells.
In a zebrafish mutant with reduced Cxcr4b signalling, Darren's group found that the primordium loses all directionality &endash; there is no forward movement and no slug trail left behind. Moreover, the static structure seems to stop producing cell clusters, as if it has to move and expel those clusters in order to generate more. One of the most interesting features of the mutant, however, is that even though the primordium's migration is stalled, a closer look reveals that its cells are still moving, tumbling over one another in an apparently random fashion.
To find out if they could
rescue the mutant and restore forward motion to the
primordium, the researchers created a genetic mosaic by
transplanting some normal, 'seeing' cells, which expressed
the Cxcr4b receptor and could therefore respond to SDF1a,
into the otherwise 'blind' mutant tissue. The normal and
mutant cells were tagged with red and green fluorescent
proteins respectively, so that Darren and his team could
track the cells' movements. Very quickly, through the
tumbling motion of the cells in the primordium, the seeing
cells found their way to the front, and the primordium once
again moved forward.
A genetic mosaic is made by taking cells expressing the
Cxcr4b receptor (red) out of a wild-type embryo and
transplanting them into a mutant lacking functional Cxcr4b
(green)
Image courtesy of Petra Riedinger, EMBL
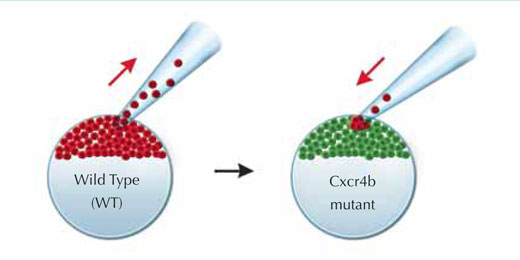
(4) sauvage = voir annexe
On fait une mosaïque
génétique en prenant des cellules qui
expriment le récepteur Cxcr4b (en rouge) au sein d'un
embryon sauvage(4) et en les transplatant chez un mutant(3)
chez lequel il n'y a pas de récepteur Cxcr4b
fonctionnel (en vert)
Mouvements désordonnés et arrêt de la progression du primordium chez le mutant Cxcr4b. Vidéo de 6s pour environ 1h de prise de vues. Une prise de vue toutes les 90s
The cxcr4b mutant primordium shows dynamic internal cell movements (compare kymograph). Images captured with a delay of 90 sec using a 25x/0.8NA objective. Movie length : 100 min (vidéo partielle ici)
La progression d'un primordium de mutant cxcr4b a été restaurée par d'insertion de cellules sauvage (en rouge). Chaque image est séparée de 3 min.
Timelapse movie shows polarisation of the wild-type cells at the front of the mass cause stretching of the tissue. Images taken every 3 min with a 20x/0.5NA objective. Movie length : 105 min.
|
In a genetic mosaic, wild-type cells (red) find their way to the tip of the primordium and project in the direction of migration, pulling mutant cells (green) with them. Image courtesy
of Darren Gilmour, EMBL
|
|
(5)
l'auteur cherche ici
à expliquer de façon simple des
résultats obtenus avec des techniques
extêmement compliquées. Personnellement je ne
peux que ressentir un fort malaise, face à ces
techniques que ni l'élève ni l'enseignant ne
peuvent maîtriser (voir
annexe) Sans
présumer de ma compétence en biologie
moléculaire, je pense qu'un bon élève
de lycée a le droit de n'être pas convaincu par
les mécanismes explicatifs proposés.
(5') l'arborisation est un mécanisme très
étudié par les biophysiciens voir
références dans le cours
de seconde sur la
ventilation,
notamment les travaux vulgarisés de Vincent
Fleury.
(6) Cette phrase sur l'instabilité du système primordium est une avancée dans la voie d'une compréhension globale du phénomène dynamique. C'est ici qu'il aurait pu s'appuyer sur l'analogie sociologique avec les gnous. Une modèle catastrophique serait possible.
(7)
pas si nouvelle que
ça... voir par exemple les journaux de
biomécanique du developpement comme le n°
spécial de The International Journal of Developmental
Biology, Vol 50, Nos 2/3, 2006, qui a pour titre
Morphodynamics.
Les articles (en anglais) sont tous disponibles gratuitement
en téléchargement: http://www.ijdb.ehu.es/
web/contents.php ?vol=50& issue=2-3
(5) Ce qui est étrange dans ces expériences, dit Darren, c'est que toutes les cellules exprimant la protéine Cxcr4b, et donc sensibles au signal SDF1, ne vont pas vers l'extrémité du primordium. Dès que quelques unes de ces cellules sont là, le mouvement désordonné cesse et le primordium progresse vers l'avant. Les cellules sensibles qui n'ont pas migré vers l'avant du primordium restent là où elles sont -«comme figés dans la glace»-. « Nous pensons que le système alors instable trouve un point d'ancrage (6)» dit-il. « Il tourne sur lui et fait des mouvements désordonnés, ce qui lui permet d'être sûr que les cellules qui peuvent guider la progression sont bien en position de leader. Et lorsqu'elles tirent, les autres se figent.»
Mais qu'est ce qui fait qu'une cellule est guide, puisque toutes les cellules sensibles ne deviennent pas des guides ? D'abord cela ne semble pas être une différence dans l'activité des gènes. « Ce ne sont pas les gènes qui disent, tu es un guide, tu es une suiveuse” dit Darren. «C'est plutôt que les gènes équipent toutes les cellules avec le récepteur et ensuite c'est un problème de lutte entre elles». «Avec sa collaboratrice Petra Haas, il pense que la dominance doit probablement être définie par la nature instable du groupe. Les mouvements désordonnés des cellules conduisent à une sorte d'attirance mutuelle temporaire pour les cellules du fait de la proximité de la source du signal. Ensuite elles s'y accrochent et, si elles sont capables de maintenir l'activation de leur récepteur, elles progressent vers l'avant. De toute façon ceci n'est pas le fin mot de l'histoire.
Une théorie de la migration cellulaire consiste à dire que les cellules guides transportent en quelque sorte les autres qui se laissent entraîner. Cependant Darren est sceptique vis-à-vis de ce modèle qu'il désigne comme celui de l'auto-stoppeur. Il préfère penser que les guides indiquent aux autres la bonne direction, et que le primordium est organisé de façon à ce que les autres suivent. Il pense qu'un principe semblable doit s'appliquer au développement de tous les organes. « Si on regarde le branchement des vaisseaux sanguins, je prédis (5') que l'on trouvera un petit nombre de cellules à l'avant qui sont sensibles au signal environnemental et qu'ensuite, par des interactions avec les autres cellules, elles influencent leur comportement» dit-il. «Les autres n'ont pas à voir le monde». Il fait l'analogie avec un faucon guettant une nuée d'étourneaux. Tous les oiseaux n'ont pas besoin de voir le faucon pour répondre par la fuite, ils n'ont besoin que de détecter la panique des voisins.
Pour l'instant tout va bien mais l'histoire se complique parce que les suiveurs ne se comportent pas tous de la même façon. Dans leurs expériences avec prise de vue sur le vivant, Darren et son équipe ont noté que, alors que les cellules de l'avant progressaient, les cellules de queue ralentissaient, conduisant ainsi le tissu à se tendre. Le thésard Guillaume Valentin vient d'identifier un autre récepteur, exprimé dans ces cellules de queue, qui répond aussi à SDF1a, mais qui conduit à un comportement différent de celui du mécanisme SDF1a/Cxcr4b - en donnant à ces cellules un certain degré d'indépendance par rapport aux cellules guide.
Quand le primordium progresse en déposant des amas de cellules en arrière, le mouvement global des cellules au sein du primordium est celui d'un recul. Darren suggère que les cellules reculant changent de récepteur. Peut-être, propose-t-il, que la combinaison des deux populations exprimant chacune un récepteur donne lieu à une sorte de mouvement capillaire dans lequel le front et la queue du primordium change alternativement. Des indices de ce processus viendraient d'expériences réalisées avec des embryons de poisson-zèbre dont l'activité de ce second récepteur est réduite et, pour la moitié d'entre eux, chez qui le mouvement coordonné manque. «La tête tire et tire mais la queue ne suit pas et parfois elle renonce et retourne à la queue » dit-il.
Si cela est exact, ces résultats posent des questions sur la manière dont l'information dynamique est transmise entre toutes les cellules du groupe. Il devient nécessaire de comprendre non seulement la signalisation mais la propagation des forces à travers des populations cellulaires, en terme d'interactions de cellule à cellule. C'est vers cela que Darren espère maintenant porter son effort. Pour l'instant la découverte du second récepteur SDF1a dans le primordium du poisson-zèbre l'enthousiaste. «L'idée selon laquelle les cellules internes peuvent aussi être sensibles est entièrement nouvelle(7) » dit-il. Si ce même principe peut être appliqué aux gnous, c'est une autre histoire.
What was strange about these experiments, says Darren, was that not all of the sensing, Cxcr4b-expressing cells found their way to the front. As soon as some were there, the random tumbling motion stopped, the primordium moved forward, and those sensing cells that had not made it to the front remained where they were &endash;"as if frozen in ice". "We think that the system finds strength in instability," he says. "It rolls around and makes random movements, and in doing so it ensures that the cells that can lead get into the position where they do lead. Whenever they pull, the others freeze."
But if not all sensing cells become leaders, what defines a leader? Whatever it is, it doesn't appear to be differences in the activity of genes. "It's not the genes that say, you're the leader, you're the follower," Darren says. "Rather the genes equip all the cells with the receptor, and after that it's a case of 'fight amongst yourselves'." He and his co-worker Petra Haas think leadership is more likely to be defined by the unstable nature of the migrating group. The random tumbling of the cells gives some a temporary bias over others, in terms of their proximity to the source of the signal. They then latch on to it, and if they are able to maintain the activation of their receptor, they move to the front. However, that is not the end of the story, by any means.
One theory of cell migration is that the leading cells somehow carry the followers, which passively allow themselves to be swept along. However Darren is sceptical of what he calls the hitchhiker model. He prefers to think that the leaders point the others in the right direction, and the primordium is internally organised such that those others then actively follow. And he believes that a similar principle will apply to the development of all organs. "If you look at the branching of blood vessels, I predict that there will be a small number of cells at the tip which sense the signals from the environment, and through cell-cell interactions they somehow influence the behaviour of the others," he says. "The others don't have to see the world." He gives the analogy of a falcon ambushing a flock of starlings. Not all the starlings have to see the falcon in order to respond appropriately by fleeing &endash; they only have to detect the panicked response of their neighbours.
So far so good, but the story gets more complicated still, because it turns out that not all the followers behave in the same way. In their live-imaging experiments, Darren and his team have noticed that as the front of the primordium noses forward, the cells in the rear slow down, causing the tissue to stretch. PhD student Guillaume Valentin has now identified another receptor, expressed by those rear cells, which also responds to SDF1a, but which triggers a different kind of behaviour to that elicited by the SDF1a/Cxcr4b pathway &endash; giving the cells at the back a certain degree of independence from the Cxcr4b-expressing leader cells.
When the primordium is moving forwards, depositing cell clusters at the back, the general motion of cells through the structure is backwards. As cells fall back inside it, Darren suspects they may switch on this second receptor. Perhaps, he speculates, the combination of the two cell populations expressing different receptors gives rise to a kind of caterpillar motion, in which the front and back of the primordium move forward alternately. Some evidence for this comes from experiments with zebrafish embryos in which the activity of the second receptor is reduced and the second half of that coordinated movement is lacking. "The leading edge pulls and pulls, but the back doesn't come with it, so eventually it gives up and tumbles back," he says.
If he is correct, the new findings raise questions about how dynamic information is transmitted through large groups of cells. It becomes necessary to understand not only signalling, but also the propagation of forces through cell populations, in terms of cell-cell interactions. This is where Darren now hopes to take his research. For now, though, he is excited by the discovery of a second SDF1a receptor in the zebrafish primordium. "The idea that the cells inside can also sense is entirely novel," he says. Whether the same principle applies to wildebeest is another matter.
article scientifique
original
(en anglais)
Haas P, Gilmour D (2006) Chemokine
signaling mediates self-organizing tissue migration in the
zebrafish lateral line. Developmental Cell 10: 673-680.
doi:
10.1016/j.devcel.2006.02.019
Résumé :
La forme de la plupart des systèmes organiques
complexes résulte de la migration dirigée de
groupes de cellules liées entre elles. Nous
détaillons ici le rôle de guide du
récepteur Cxcr4b à la chemokine, dans la
régulation de la migration collective d'un de ces
tissus : le primordium de la ligne latérale du
poisson-zèbre. À l'aide d'imagerie in vivo
nous montrons que la forme et l'organisation du primordium
est étonnamment labile et que les mouvements des
cellules internes ne sont pas coordonnés chez les
embryons dont la signal Cxcr4b est réduit. Des
expériences de mosaïque génétique
révèlent que des cellules de primordium de
mutants simples cxcr4b peuvent organiser un primordium
mutant cxcr4b entier et rétablir ainsi la migration
et l'organogénèse de la ligne latérale.
Ces résultats indiquent un rôle du signal
chemokine dans l'auto-organisation de la migration des
tissus lors de la morphogénèse.
Vidéos
en cliquant sur ce
lien vous pouvez avoir accès à l'article
original et à de superbes vidéos
- accès
direct aux vidéos
Explication de texte par un enseignant de lycée (le lycéen européen est censé être le public de cet article)
Cet article destiné à un public SCOLAIRE est emblématique à bien des égards et c'est pour cela que je le met à disposition des élèves et collègues:
- l'anglais est devenu la langue européenne scientifique, même pour l'enseignement (ce qui n'est peut-être pas une avancée... personnellement je n'arrive pas à penser en anglais)
- la construction de l'article permet
à un élève de voir ce qu'il faut faire
et surtout ne pas faire.
+ La référence aux gnous, qui fait le titre,
et la comparaison entre le comportement social des animaux
et des cellules est intéressante et c'est une bonne
image pour les élèves (parallèle
cellule-animal). Mais elle n'est pas exploitée si ce
n'est par un paragraphe introductif, une phrase
maladroitement placée et la dernière ligne de
conclusion ratée. On reste sur sa faim. Or il y
vraiment une analogie à creuser
(toute analogie est vraie,
René
Thom).
Voir ci-contre
----->
+ Ensuite, et c'est très souvent le cas des articles
scientifiques, on arrive à intéresser le
lecteur que l'on mène à une première
conclusion. Puis l'auteur se sent obligé de dire que
"mais tout est en fait beaucoup plus compliqué" et il
fournit alors un autre élément qu'il n'avait
pas donné au début et qui change totalement
l'interprétation. C'est frustrant intellectuellement.
Je pense que la technique du polar à REBONDISSEMENT
est plus déroutante que
pédagogique.
- les images et les films sont très intéressants et devenus de plus en plus accessibles dans des laboratoires très équipés (EMBL par exemple); c'est un média de diffusion-enseignement incontournable. À quand une libéralisation de ces médias. J'ai fait des petites réductions de quelques films pour vous donner envie de télécharger les originaux en grand format.
- l'effarante complexité des techniques (voir annexe) est gommée notamment par l'apparente simplicité d'une vidéo que tout le monde croît pouvoir naïvement interpréter ("je crois ce que je vois"... aucun sens n'est plus facile à tromper... surtout avec des techniques numériques). La description des protocoles et techniques employées n'est même pas réellement faite dans l'article du fait de leur complexité (les protocoles sont dans d'autres publications référencées). On renvoie à des techniques de plus en plus spécialisées, et qui possèdent leurs propres schèmes explicatifs.... moléculaires.
- la description naïve des théories explicatives sous-jacentes est symptomatique de la quasi impossibilité de vulgarisation des techniques de la biologie moléculaire. Ce qui empêche tout enseignement au niveau du lycée.
- la suspicion d'un mécanisme plus général, esquissée rapidement par l'auteur sans qu'il ose s'y aventurer -dans le cadre de cet article pour les élèves-, met en évidence, à mon avis, la nécessaire remise en cause de l'explication moléculaire (l'auteur travaille à l'EMBL dans un laboratoire de biologie moléculaire mais orienté biophysique: voir la page du laboratoire de Darren GILMOUR, l'auteur de cet article: http://www-db.embl.de/ jss /EmblGroupsHD/ g_266.html ) et pourtant cet article ne parle pas de biophysique... quelle occasion manquée.
Rester dedans ou
sortir du paradigme ?
En fait, et c'est même ici le but de l'article, dans
ce laboratoire de biologie moléculaire, comme dans
vos cours habituels de lycée, on pense que les
cellules sont en quelque sorte des
automates qui réagissent
à un certain nombre de signaux. Pour la
progression des cellules du primordium, l'idée des
auteurs était donc de trouver des molécules
directrices (chémokines) auxquelles les cellules
seraient sensibles grâce à des
récepteurs adhoc codés par des
gènes. Grâce à la sélection
génétique ils ont fabriqué une
souche de poisson-zèbre "mutée" dont les
récepteurs sont déficients et qui
présente un primordium dont la progression est
arrêtée. Ils s'attendent donc, dans
l'expérience de la mosaïque, à voir
UNIQUEMENT les cellules "non mutées" progresser. Or
ils observent que les cellules non "mutées"
entraînent avec elles la totalité du primordium
et que les cellules "mutées" peuvent, elles aussi,
jouer le rôle de guide, après avoir
été activées par les cellules "non
mutées". Les auteurs envisagent alors des
systèmes inconnus de communication et
d'entraînement.
Le problème
dans ces expériences est que l'on part avec tout une
série d'hypothèses
sur le déplacement des cellules embryonnaires sous
l'action de substances chimiques morphogènes
(chémokines) et de gènes codant pour des
récepteurs (qui déterminent la
sensibilité puis le comportement des cellules). La
sensibilité des cellules dépendant de la
concentration de la substance et du nombre (et de
l'activité) des récepteurs.
Finalement le
raisonnement proposé est extrêmement
SIMPLISTE.
Mais, et je penche pour cette hypothèse, il est
possible que l'on fasse fausse route depuis le début.
Que le déterminisme du déplacement ne soit pas
chimique. Que les souches sélectionnées ne
soient pas des "mutants" pour seulement un récepteur
mais qui présentent un réseau
métabolique autrement altéré...
Cet article est donc
emblématique du carcan dans lequel un chercheur est
amené à se placer lorsque ses résultats
reposent bien davantage sur des prouesses techniques que sur
une avancée intellectuelle dans la
modélisation d'un phénomène.
(ces questions sont
abordées sur la
page de biologie
théorique et sur
la page
des modèles
thomiens).
Données sur les techniques de génétique chez le poisson-zèbre
in Biologie du développement, Gilbert, De Boeck, 2004, p 345s, 102
le n° 123 de 1996 de Development (en anglais) est consacré aux mutants du poisson-zèbre: http://dev.biologists.org/ content/vol123 /issue1/
Le poisson-zèbre (Danio rerio) est le premier vertébré chez qui une mutagénèse intensive a été tentée. En traitant les parents avec des mutagènes et en croisant de façon sélective leur descendance, les chercheurs ont trouvé des milliers de mutations rapportées à des gènes organisateurs du développement (voir réf Development, 1996, 123 ci-contre). Le processus de sélection des mutants (screening) est tout simplement de chercher des individus "mutés" dans les secondes générations (F2) après croisement de l'individu soumis aux mutagènes avec un individu sauvage. Lorsque l'on obtient un individu qui présente une caractéristique originale de développement qui a résisté à ce filtre, on le qualifie de muté, ce que l'on représente avec le formalisme morgano-mendélien (allèle dominant (M) ou récessif(m), homozygote ou hétérozygote... M/+, m/+, M/M, m/m... comme pour la drosophile).
L'étude génétique
est grandement facilitée par le développement
de l'embryon à "ciel-ouvert" sans structure
protectrice.
De même, l'embryon de poisson-zèbre
possède une sensibilité exceptionnelle aux
molécules anti-sens de type morpholino
(oligomères voisins des petits ARN antisens mais
avec des sucres à 6 carbones (cycles morpholines)
leur conférant une résistance aux
nucléases) qui se fixent aux ARNm et inhibent le
démarrage de leur traduction.
Enfin, la technique la plus spectaculaire est la fabrication de poissons-zèbres transgéniques dont les cellules embryonnaires sont transfectées par le gène (dit rapporteur) de la protéine à fluorescence verte GFP (Green Fluorescent Protein) lié à des séquences régulatrices (promoteurs et amplificateurs) d'une protéine spécifique du poisson-zèbre. On peut ainsi voir s'exprimer le gène de la GFP lorsque le gène correspondant aux séquences régulatrices est sollicité au cours du développement. Les zones vertes fluorescentes de l'embryon sont les zones où les séquences régulatrices insérées sont actives.
illustrations (et c'est tout) du
développement embryonnaire su
poisson-zèbre: http://www.inrp.fr/
Acces/biotic/develop/ controle/html/
devpois.htm
http://www.inrp.fr/
Acces/biotic/ develop/controle/ images/4cellszeb.gif
Je vous conseille plutôt le film (téléchargez le fichier lié, modifiez son extension en ".mov" seul puis visionnez-le : http://biodev.obs-vlfr.fr/ recherche/ lepage/images/ cleave.mov%20copy) qui va de la première division à la fin de la gastrulation chez le poisson-zèbre sur la page de l'équipe de Thierry Lepage à Villefranche su mer (http://biodev.obs-vlfr.fr/recherche/lepage/). 30s de film correspondant à 11h20s de développement soit une accélération d'environ 1321 fois.
Un article de
Médecine-Sciences:
Contribution du poisson zèbre à l'étude
moléculaire du développement du coeur des
vertébrés
Didier Y.R. Stainier,
Médecine Sciences, 2002, 448
http://ist.inserm.fr/basismedsci/
2002/ms_4_2002/ sommaire/448.pdf