2 - L'eau, les éléments minéraux, les gaz et les petites molécules organiques
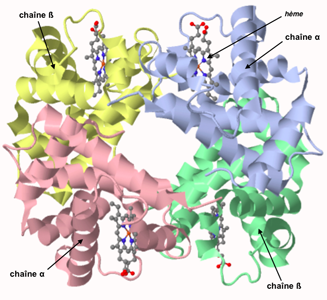
Pour des données sur l'eau cellulaire voir la page "au-delà de la cellule". Pour les minéraux il est nécessaire de savoir qu'ils sont avant tout hydratés (ils sont entourés d'une sphère d'hydratation; par exemple K+,4H2O) et ensuite souvent liés à certaines molécules : le Fe en est un exemple évident au sein de l'hème de l'hémoglobine (voir ci-dessous).
+ Quelques atomes : l'atome de chlore ou celui de sodium ou encore de magnésium. JSmol montre par défaut le rayon de Van der Waals à 15% mais il faut visualiser 2 atomes pour comparer leur rayon atomique par exemple. Le tableau ci-dessous présente les couleurs conventionnelles et le lien ci-contre renvoie à une image des rayons atomiques représentés dans Jmol.
+ Deux gaz : - le dioxygène et le dioxyde de carbone
+ Les molécules organiques sont composées de carbone et sont produites par les êtres vivants. La chimie du carbone s'appelle la chimie organique alors que celle des autres éléments est appelée chimie minérale ou chimie inorganique. ( couleurs des atomes CPK
 )
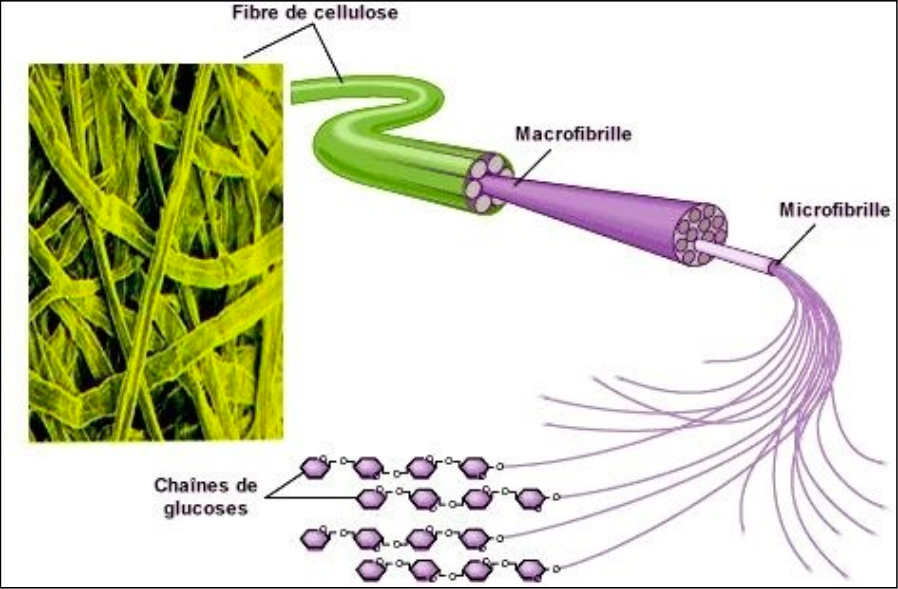
)Les molécules organiques sont composées habituellement - au plus - de 5 atomes : carbone (C), hydrogène (H), oxygène (O), azote (N), phosphore (P) et soufre (S) ; c'est pour cela que l'on les surnomme les CHONPS. De nombreuses molécules organiques contiennent des groupes non organiques associés par exemple le fer (Fe) ou le manganèse (Mn).
<< Applet du bas
Commandes JSmol: Modèles de la molécule : compact, squelette, boules et bâtons
Il est ensuite nécessaire de savoir le nombre de liaisons de covalence que peuvent établir les éléments cités (cette vision est simpliste, mais pratique):
- l'hydrogène ne peut établir une seule liaison
- alors que l'oxygène en établit deux (par exemple dans l' eau);
- le soufre organique peut engager 2 liaisons (groupe -SH comme dans l'acide aminé cystéine),
- l'azote 3 liaisons (NH3 par exemple dans les groupes amine des acides aminés : le plus simple étant la glycine),
- le carbone 4 liaisons (comme dans le méthane (CH4) produit par de nombreux microorganismes) et
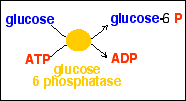
- le phosphore 5 liaisons (comme dans l'acide phosphorique (H3PO4) qui intervient dans d'innombrables réactions de phosphorylation sous forme du groupe phosphoryl : -PO32-: sa liaison avec un carbone est très énergétique. Sous forme ionique libre, l'anion PO43- se conjuge avec un H+ pour donner l'ion hydrogénophosphate HPO42- ou phosphate inorganique : Pi noté aussi Ⓟ). La réaction de phosphorylation de l'ADP en ATP est fortement endergonique (environ 7,3 kcal/mol) : Pi + H+ + ADP = ATP + H2O . Dans le sens inverse, l'hydrolyse de l'ATP est fortement exergonique (voir ci-dessous pour le vocabulaire).
Les groupes chimiques - groupes fonctionnels - à connaître pour la biochimie en lycée sont très réduits.
- le groupe alcool (-OH) que l'on trouve en trois exemplaires chez le glycérol qui est un tri-alcool qui entre dans la composition d'un grand groupe de lipides : les glycérides. Le cholestérol est aussi un important alcool qui intervient dans la composition des membranes et dont dérivent les hormones stéroïdes comme la corticostérone (un minéralocorticoïde) (voir page dédiée). Les dérivés du cholestérol sont souvent classés avec les molécules lipidiques (voir ci-dessous) du fait de leur affinité avec les membranes. On trouve aussi des groupes alcools dans tous les glucides, car ce sont des polyalcools (ayant plusieurs groupes alcool): par exemple le sucre le plus simple à 3 carbones (un triose) : le glycéraldéhyde. Il possède 2 groupes alcool, mais aussi l'un des deux autres groupes des glucides simples (oses) qui sont :
- le groupe cétone (=C=O) que l'on trouve chez les cétoses - comme la dihydroxyacétone-,
- et le groupe aldéhyde (-HC=O) chez les aldoses comme le glycéraldéhyde;
Les deux derniers groupes se trouvent tous les deux chez les acides aminés comme la glycine :
- le groupe acide carboxylique (-(OH)C=O) et
- le groupe amine (-NH2).
+ Quelques petites molécules impliquées dans les transferts d'énergie dans la cellule :
- l'adénosine triphosphate (ATP) la forme la plus énergétique
- l'adénosine diphosphate (ADP) la forme intermédiaire
- l'adénosine monophosphate (AMP) la forme la moins énergétique ;
vous noterez que l'adénosine est un ribonucléoside (adénine + ribose), composant des ARN.
 fichier volumineux, patience)
fichier volumineux, patience)