|
La chaux est de l'oxyde de calcium CaO qui ne
contient donc pas de carbone. La chaux vive est une
chaux fraîchement préparée (par
chauffage à 600-800°C de calcaire: CaCO3). Elle
possède des propriétées basiques
(attire les ions H+) et donc attaque la matière
organique: il faut donc ne pas la manipuler avec les doigts
(si vous placez un morceau de viande à son contact,
elle se liquifie) . La chaux absorbe
facilement et réversiblement l'eau et le gaz
carbonique (d'où la fabrication de mortiers
constitués de chaux, de sable et d'eau; la chaux
s'hydrate, puis se carbonate, à l'air, l'ensemble
donnant une masse dure dont le volume s'accroît lors
de la prise, contribuant ainsi à la solidité
des scellements). La chaux éteinte est
donc un complexe solide d'oxyde de calcium de dioxyde de
carbone et d'eau. Si l'on ajoute beaucoup d'eau, cette chaux
éteinte devient chaux hydratée de
formule Ca(OH)2. En solution saturée la chaux est
apellée "eau de chaux" et sert à la
caractérisation du dioxyde de carbone (voir expériences).
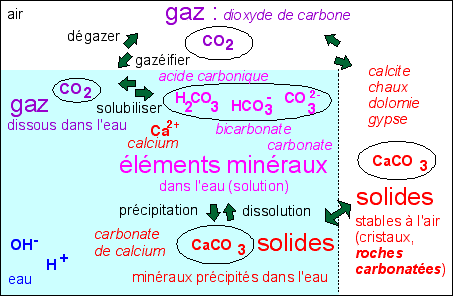
CaCO3
<=> CaO + CO2
CaO+ H2O <=>
Ca(OH)2
Ca(OH)2 + CO2 +
H2O <=> Ca(OH)2 +
H+ + HCO3- <=>
Ca2+, (OH-)2 +
2H+,CO32- <=>
CaCO3 + 2H2O
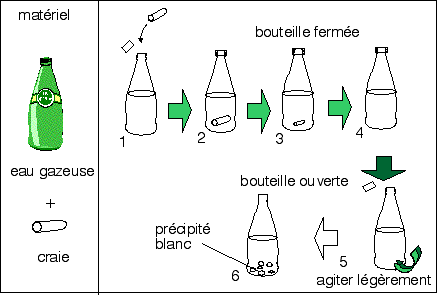
Pour fabriquer de la
chaux vive on peut chauffer dans un tube à essai du
calcaire finement broyé et observer un
dégagement de CO2 qui trouble par exemple l'eau de
chaux (La terre,
50 expériences pour découvrir notre
planète, André Prost, p 84-85, Belin,
1999)
Les carbonates sont des solides contenant l'ion
carbonate: CO32-
. Trois sont essentiels:
- calcite: minéral de
formule CaCO3 cristallisant dans le
système rhomboèdrique (faces losanges
 )
que l'on peut facilement trouver dans les roches
métamorphiques (voir cours sur les roches) )
que l'on peut facilement trouver dans les roches
métamorphiques (voir cours sur les roches)
- aragonite, minéral de même
formule chimique que la calcite (CaCO3) mais
cristallisant dans le système orthorhombique (sous
forme de petites aiguilles le plus souvent) mais qu'il
est beaucoup plus rare de voir...
- dolomite: minéral de formule
(Ca,Mg)CO3 dans lequel le calcium et le
magnésium se partagent l'association à
l'ion CO32-.
Les calcaires sont des
roches carbonatées (ayant plus de 50% de
carbonates) qui sont majoritairement constituées de
calcite (plus de 50% des minéraux). Un calacaire pur
à moins de 5% d'impureté (souvent dolomie). Un
calcaire dolomitique peut atteindre 50% de dolomite
cristallisée. La dolomie est une roche
majoritairement composée de dolomite. On notera que
si les calcaires font effervescence avec l'acide
chlorhydrique dilué (10%) à froid, les
dolomies ne réagissent pas, ce qui permet de
distinguer ces deux roches.
Le terme "calcaire" peut être aussi utilisé
comme adjectif pour désigner une roche contenant une
grande proportion de calcaire mais dont ce n'est pas le
composant majoritaire (par exemple un sable calcaire, une
marne calcaire...).
Le gypse est un sulfate (SO4) hydraté (2
H2O) de calcium (Ca) de formule chimique:
CaSO42H2O. Si l'on chauffe le gypse il
libère son eau qui s'évapore et donne le
plâtre: CaSO40,5 H2O qui
est un sulfate légèrement hydraté.
Pour fabriquer du
plâtre on peut chauffer dans un tube à essai du
gypse finement broyé et observer un dégagement
d'eau qui se condense dans un tube coudé
(La terre, 50
expériences pour découvrir notre
planète, André Prost, p 86-87, Belin,
1999)
|